
题目列表(包括答案和解析)
18.pH相等的盐酸溶液和醋酸溶液分别与足量NaAlO2溶液反应,下列说法正确的是( )
A.当盐酸溶液和醋酸溶液的体积相等时,盐酸产生的沉淀多
B.当盐酸溶液和醋酸溶液的体积相等时,醋酸产生的沉淀多
C.若产生沉淀的质量相等,则加入盐酸溶液的体积比醋酸多
D.若产生沉淀的质量相等,则加入醋酸溶液的体积比盐酸多
答案:BC
解析:当盐酸溶液和醋酸溶液的pH和体积均相等时,由于醋酸为弱电解质,所以醋酸溶液提供的氢离子的物质的量比盐酸多,所以与足量的偏铝酸钠反应时,醋酸产生的沉淀多;当产生沉淀的量相等时,消耗的酸的物质的量相等,但醋酸溶液的体积比盐酸溶液的体积小。
17.下列有关溶液的叙述正确的是
A. 常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol·L-1
B. 在pH=2的醋酸溶液中加入等体积c(酸)=2mol·L-1的某酸溶液后,混合溶液的pH一定会减小
C. pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液的m倍和n倍,若稀释后两溶液的pH仍相同,则m>n
D. 导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多
答案:C
解析:常温下的醋酸铵溶液,铵根离子和醋酸根离子均会水解,它们分别水解得到的H+和OH-的浓度相等,故溶液呈中性,此时,c(H+)=c(OH-)>10-7mol·L-1;B项中若加入的酸的酸性比醋酸还要弱,则有可能使溶液的pH增大;溶液的导电性取决于溶液中自由移动离子的浓度而非数目,D项错。
16.将1molCO和1molH2O充入容器中,在催化剂存在下发生反应
H2O (g) + CO(g)  H2 (g) + CO2(g)
H2 (g) + CO2(g)
达到平衡时,发现有50%的CO转化为CO2。在其他条件不变的情况下,若将1molCO和2molH2O充入反应器中,则反应达平衡后,混合气体中CO2的体积分数可能为( )
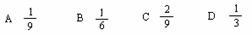
答案:C
解析:若转化率为50%,CO2的体积分数为1/6,若转化率为100%,CO2的体积分数为1/3,由于CO的转化率介于50%--100%之间,所以CO2的体积分数介于1/6--1/3之间。
15.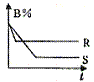 下图中的两条曲线分别表示200℃和300℃时,有反应A(g)+B(g)
下图中的两条曲线分别表示200℃和300℃时,有反应A(g)+B(g) C(g),△H体系中B的百分含量和时间t的关系,下列对△H的数值和表示300℃
C(g),△H体系中B的百分含量和时间t的关系,下列对△H的数值和表示300℃
时的变化曲线的说法正确的是( )。
A. △H<0,R曲线 B. △H>0,R曲线
C. △H<0,S曲线 D. △H>0,S曲线
答案:A。
解析:由图像中的曲线可知R曲线先达到平衡(先“拐”先“平”),所以R为300℃时的变化曲线;由图像又可知温度升高,B%变大,平衡左移,故正反应为放热反应,△H<0。
14.将pH=1的盐酸平均分成2份,1份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.9:1 B.10:1 C.1l:1 D.12:l
解析:此题是关于pH的计算,综合性强,涉及溶液的稀释和酸碱中和后混合液的pH计算,具有一定的难度,解题的关键是概念清楚,公式准确,根据题意求解。将pH=l的盐酸加适量的水,pH升高了1,则体积是原盐酸体积的10倍,说明所加的水的体积是原溶液的9倍;另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1。可设碱液体积x。依题意可列出下列等式:10-1×1-10-1·x=10-2(1+x),解之得x=9/11,则加入的水与NaOH溶液的体积比为9:9/11=11:1,故答案为C。关于pH的计算,在熟练掌握基础知识的同时,还应根据题目的要求,灵活运用,解决实际问题。
答案:C
13.下列反应中氧化剂与还原剂的物质的量之比为1:2,且电子转移数为0.1mol的是
A.已知:Cu+2Fe3+=2Fe2++Cu2+。将6.4gCu片放入0.1 mol/L的FeCl3溶液中充分反应
B. R2O82-离子在一定条件下可以把Mn2+氧化成MnO4-,而R2O82-离子变为RO42-,若得到的溶液中含MnO4-0.2mol
C. C1O2是一种杀菌、消毒、效率高、二次污染小的水处理剂。实验室制备原理:2KClO3
+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L
2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L
D.臭氧可使湿润的KI淀粉试纸变蓝,其原理为:O3+2KI+H2O=2KOH+I2+O2,测得1000mL溶液中的pH=13
答案:D。
解析:A项中氧化剂为Fe3+,还原剂为Cu,故氧化剂与还原剂的物质的量之比为2:1,6.4gCu失去电子数为0.2mol,则电子转移数也为0.2mol;B项中每1mol氧化剂R2O82-变为RO42-得到2mol电子,每1mol还原剂Mn2+氧化成MnO4-时得到5mol电子,所以氧化剂与还原剂物质的量之比为5:2,生成MnO4-0.2mol,转移的电子数为1mol;C项中氧化剂与还原剂物质的量之比为2:1,得到的气体为0.05mol,其中ClO2为0.025mol,转移的电子数为0.025mol;D项中氧化剂与还原剂物质的量之比为1:2,生成的KOH为1.0 0.1mol=0.1mol,则有0.1molI-被氧化为I2,转移的电子数为0.1mol。
0.1mol=0.1mol,则有0.1molI-被氧化为I2,转移的电子数为0.1mol。
12. 在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g);△H<0
在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g);△H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
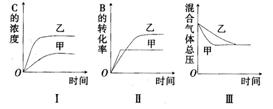
下列判断一定错误的是( )
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
解析:图I中,在乙条件下的化学反应速率,明显比在甲条件下的化学反应速率快;在乙条件下C的平衡浓度,比在甲条件下的C的平衡浓度大,相比较而言,条件乙既有利于此反应的化学反应速率增大又有利于反应向正反应方向进行。说明甲、乙两个条件不仅影响化学反应速率,而且影响化学平衡,而催化剂不影响化学平衡,因此A项是错误的。图Ⅱ在乙条件下的化学反应速率,比在甲条件下的化学反应速率慢,如果甲、乙两个条件是压强对反应的影响,从化学反应速率来讲,是甲的压强较高,而在乙条件下B的转化率,比在甲条件下B的转化率高,说明条件乙有利于反应向正反应方向进行,而所给反应正反应气体体积减小,不符合勒夏特列原理,因此B项也是错误的。温度高化学反应速率快,则甲的温度高,但是由于正反应放热,不利于反应向正反应方向进行,因此C项是正确的。催化剂只改变化学反应速率不影响化学平衡,因此D项是正确的。
答案:A B
11、具有相同电子层结构的三种微粒An+、Bn-、C,下列分析正确的是( )
A.原子序数关系:C>B>A
B.微粒半径关系:Bn->An+
C.C微粒是稀有气体元素的原子
D.原子半径关系是A<B<C
解析:此类题目首先要根据题给信息,确定各元素在周期表中的相对位置,然后根据元素周期律加以对照。具体解答为:设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数则为Z-n,则原子序数为A>C>B,A错。因An+、Bn-具有相同的电子层结构,阴离子半径大于阳离子半径,即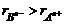 ,B项正确。An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构相同于An+、Bn-,所以C必为稀有气体元素的原子;B、C为同一周期的元素,其原子半径C>B,而A应处于B、C的下一周期,故A的原子半径应大于B。故C项正确,D项错误。答案为BC。
,B项正确。An+、Bn-都应具有稀有气体的电子层结构,C的电子层结构相同于An+、Bn-,所以C必为稀有气体元素的原子;B、C为同一周期的元素,其原子半径C>B,而A应处于B、C的下一周期,故A的原子半径应大于B。故C项正确,D项错误。答案为BC。
10.将纯锌片和纯铜片按下图所示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
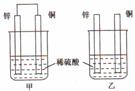 A.两烧杯中铜片表面均无气泡产生
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
解析:本题考查了置换反应和原电池的有关知识。
甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn + H2SO4 = ZnSO4 + H2↑,原电池的构成加快了反应速率。乙装置中只是锌片与稀硫酸间发生了置换反应:Zn + H2SO4 = ZnSO4 + H2↑。所以甲中铜片表面有气泡产生,A不正确;乙中不构成原电池,铜片不是电极,B不正确;原电池能加快反应速率,故产生气泡的速度甲比乙快,D不正确。
答案:C
9.下图中每条折线表示周期表IVA~VIIA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )

A.H2S B.HCl C.PH3 D.SiH4
解析:本题考查的是分子间作用力、氢键与物质沸点的关系,同时考查了学生从图表中获取信息的能力。
根据所学知识,在第二周期族IVA~VIIA非金属元素的气态氢化物中,只有NH3、H2O、HF分子之间存在氢键,它们的沸点高于同主族其他元素气态氢化物的沸点,所以a点所在的曲线表示的是IVA族元素的气态氢化物,a点代表的是SiH4。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com