
题目列表(包括答案和解析)
14.(18分)现有一份“将二氧化硫转化为硫酸铵”的资料,摘录如下:
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在
400℃时废气以5 m3·h-1的速率通过五氧化二钒催化剂层与20 L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。
利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是 ,简述不采用2∶1的理由是 。
(2)通过计算,说明为什么废气以5 m3·h-1的速率与20 L·h-1速率的氨气混合?
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵多少吨?消耗氨气多少吨?
13.(12分)可逆反应aA(g)+bB(g) cC(g)+dD(g),取a mol A和b mol B置于V L容器中,1
min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为 mol·
cC(g)+dD(g),取a mol A和b mol B置于V L容器中,1
min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为 mol·
L-1,C的浓度为 mol·L-1。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 。
12.(5分)反应A+3B==2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15 mol·L-1·s-1;②v(B)=0.6mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1。该反应进行的快慢顺序为 。
11.(8分)根据化学方程式2N2O 2N2+O2,填充表中①、②、③、④空栏处测定反应速率的实验数据和计算结果。
2N2+O2,填充表中①、②、③、④空栏处测定反应速率的实验数据和计算结果。
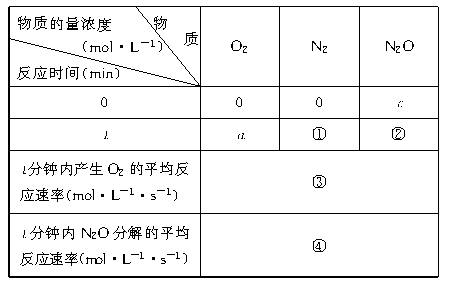
①
②
③
④
10.(12分)(2001年上海高考题)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
|
实验 序号 |
时间 浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20 min时间内平均速率为 mol·(L·min)-1。
(2)在实验2中A的初始浓度C2= mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1?(填“>”“=”或“<”=,且C3 1.0 mol·L-1(填“>”“=”或“<”=。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”或“放热”)。理由是 。
9.反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
|
|
c(H2)(mol·L-1) |
c(Cl2)(mol·L-1) |
v(mol·L-1·s-1) |
|
① |
1.0 |
1.0 |
1.0k |
|
② |
2.0 |
1.0 |
2.0k |
|
③ |
2.0 |
4.0 |
4.0k |
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=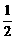 ,n=
,n=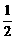
C.m=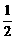 ,n=1 D.m=1,n=
,n=1 D.m=1,n=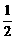
8.在锌片和盐酸的反应中,加入下列试剂,可使生成氢气的速率变慢的是
A.硫酸铜晶体 B.水
C.氯化钡晶体 D.醋酸钾晶体
7.在2 L密闭容器中充入2
mol SO2和一定量O2,发生2SO2+O2 2SO3反应,进行到4 min时,测得n(SO2)=0.4
mol,若反应进行到2 min时,容器中n(SO2)为
2SO3反应,进行到4 min时,测得n(SO2)=0.4
mol,若反应进行到2 min时,容器中n(SO2)为
A.1.6 mol B.1.2 mol
C.大于1.6 mol D.小于1.2 mol
6.反应4A(g)+5B(g)===4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,
C的物质的量增加了0.30 mol。下列叙述正确的是
A.A的平均反应速率是0.010 mol·L-1·s-1
B.容器中含D物质的量至少为0.45 mol
C.容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D.容器中A的物质的量一定增加了0.30 mol
5.在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)(mol·L-1·s-1)表示且v(A)、v(B)、v(C)之间有以下关系:v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为
A.2A+3B 2C
2C
B.A+3B 2C
2C
C.3A+B 2C
2C
D.A+B C
C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com