
题目列表(包括答案和解析)
4.为什么整块金属会具有金属光泽而金属粉末常呈暗灰色或黑色?
由于金属原子以最紧密状态堆积排列,内部存在自由电子,所以当光线投射到它的表面时,自由电子可以吸收所有频率的光,然后很快放出各种频率的光,这就使绝大多数金属呈现钢灰色以至银白色光泽。而金显黄色,铜显赤红色,铋为淡红色,铯为淡黄色,铅为灰蓝色,是由于它们较易吸收某些频率的光。
在粉末状态时,金属的晶面取向杂乱,晶格排列的不规则,吸收可见光后辐射不出去,所以为黑色。
3.金属晶体与其它常见晶体的比较
|
晶体类型 |
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
|
实例 |
NaCl晶体 |
金刚石 |
干冰 |
镁 |
|
|
构成晶体的微粒 |
阴、阳离子 |
原子 |
分子 |
金属离子、自由电子 |
|
|
微粒间的相互作用 |
离子键 |
共价键 |
范得华力 |
金属键 |
|
|
物理性质 |
硬度 |
较大 |
很大 |
很小 |
较小 |
|
熔沸点 |
较高 |
很高 |
低、很低 |
多数较高 |
|
|
导电性 |
晶体不导电(熔化时或水溶液中导电) |
一般为非导体 |
非导体(有的水溶液能导电) |
良导体 |
2.金属的物理特性及解释
(1)金属都是电的良导体,通常情况下,自由电子在金属晶体内部的自由电子在金属内部作无规则的热运动,当金属的两端存在电势差的时候,在电场力的作用下,这些自由电子便作定向的移动,酷似人的定向移动就形成“人流”一样,电子的定向移动也便成了电流。
(2)在金属晶体内,自由电子运动时与金属离子相碰撞,引起两者的能量交换,致使整块金属达到了同样的温度,这是金属导热的原因。
大多数金属有良好的导电性和导热性,是由于这两种性质都与自由电子有关,所以善于导电的金属也善于导热。常见的几种金属的导电、导热能力由大到小的顺序为:
Ag、Cu、Au、Al、Zn、Pt、Sn、Fe、Pb、Hg。
(3)金属受外力作用晶体中各层之间发生相对滑动,但金属离子与自由电子间的较强的相互作用仍然存在,也就金属虽发生变形而不致破碎。
金属的延性,是指金属可以抽成丝。例如:最细的白金丝直径不过1/5000mm;金属又有展性,指的是可以压成薄片,最薄的金箔,只有1/10000mm厚。延展性最好的金属是金。但也有少数金属,如锑、铋、锰等,性质较脆,没有延展性。
|
项目 |
内容 |
|
|
周期表中的分布 |
位于从硼到砹的左下方,在已知的109种元素中有87种是金属元素 |
|
|
原子结构的特征(最外层电子) |
最外层电子数一般少于4个(ⅣA-ⅥA的某些金属元素有4-5个,但核外电子层数较多,原子半径较大) |
|
|
组成微粒 及通常状态 |
金属离子和自由电子 通常情况下都是金属晶体,只有汞在常温下呈液态 |
|
|
分类 |
冶金工业 |
黑色金属:铁、铬、锰 有色金属:除铁、铬、锰以外的金属 |
|
密度 |
轻金属:密度小于4.5g/cm3 重金属:密度大于4.5g/cm3 |
|
|
从与人的接触分 |
常见金属:如铁、铜、铝等 稀有金属:如锆、铪、铌等 |
|
|
物理性质(通性) |
有金属光泽、不透明,热和电的良导体,有良好的延性和展性 |
1.金属的晶体结构:
金属具有一些共同性质,是由它们的原子结构和晶体结构的相似性决定的。金属的价电子较少,容易失去价电子变成金属离子,这些释出的价电子,不在属于那个或那几个指定的金属离子,而是整体金属的“集体财富”。它们在整个晶体内自由移动,人称“自由电子”。有人描述金属晶体内的实际情况是“金属离子沉浸在自由电子的海洋中”。换言之,是金属离子和自由电子之间存在着较强的电性作用,使许多金属离子和自由电子相互结合在一起形成晶体。
但是金属晶体中的“金属离子和自由电子之间存在着较强的电性作用”有相对强弱之分。一般来说,价电子数越多,原子半径越小,“作用”愈强,其熔沸点相对较高,密度、硬度也相对较大。
例如:同一主族金属元素的原子,价电子数目相同,从上到下随原子序数的递增,电子层数增多,原子半径增大,金属晶体中金属阳离子与自由电子的作用逐渐减弱,因此,它们的熔点逐渐降低,硬度逐渐减小。如:碱金属熔点钠比钾高,硬度钠比钾大。
同一周期金属元素的原子的电子层数相同,从左到右随原子序数的递增,价电子数增多,原子半径减小,金属晶体中金属阳离子与自由电子的作用逐渐增强。因此它们的熔点逐渐升高,硬度逐渐增大。如:按钠、镁、铝的顺序熔点依次升高,硬度逐渐增大。
16.(12分)(2001年全国高考卷)已知Fe2O3在高炉中有下列反应:
Fe2O3+CO 2FeO+CO2
2FeO+CO2
反应形成的固体混合物(含Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe)∶m(O)表示。
(1)上述固体混合物中,m(Fe)∶m(O)不可能是 (选填a、b、c多选扣1分)。
a.21∶9 b.21∶7.5 c.21∶6
(2)若m(Fe)∶m(O)=21∶8,计算Fe2O3被CO还原的百分率。
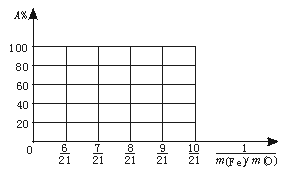
(3)设Fe2O3被CO还原的百分率为A%,则A%和混合物中m(Fe)∶m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]A%= 。
请在下图中画出A%和m(Fe)∶m(O)关系的图形。
(4)如果Fe2O3和CO的反应分两步进行:
3Fe2O3+CO 2Fe3O4+CO2 Fe3O4+CO
2Fe3O4+CO2 Fe3O4+CO 3FeO+CO2
3FeO+CO2
试分析反应形成的固体混合物可能的组成及相应的m(Fe)∶m(O)[令m(Fe)∶
m(O)=21∶a,写出a的取值范围]。将结果填入下表。
|
混合物组成(用化学式表示) |
a的取值范围 |
|
|
|
15.(10分)将一生锈的铁片置于稀HNO3中充分反应后,共收集到11.2 L(标准状况)NO气体,溶液中还剩余5 g固体残渣,在过滤后的滤液中通入35.5 g氯气,恰好使溶液中的Fe2+全部氧化。求原带锈铁片的质量和铁锈的质量分数(铁锈成分以Fe2O3计)。
14.(10分)A、B、C、D、E分别是铁的单质或铁的化合物。其相互反应关系如下图所示:
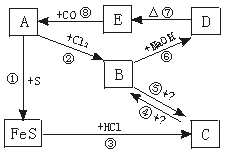
根据上图所示变化,要求回答:
(1)推断A、B、C、D、E各是什么物质
A 、B 、C 、D 、E ;
(2)写出各步反应的化学方程式:
① ;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ ;
⑧ 。
13.(6分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图进行反应。又知E溶液是无色的,请回答:
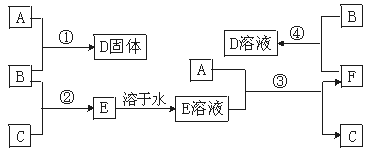
反应流程
(1)A是 ,B是 ,
C是 。(请填化学式)
(2)反应①的化学方程式为: 。
(3)反应③的化学方程式为: 。
(4)反应④的化学方程式为: 。
12.(6分)有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白:
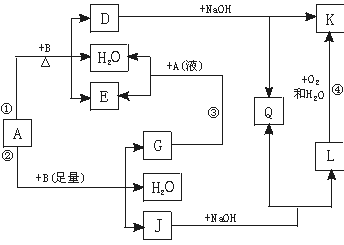
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答): 。
11.(6分)在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成 而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的 气体,它们把该红色物质还原成的黑色化合物是 ,同时还有未烧的碳颗粒,而制得了青色砖瓦。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com