
题目列表(包括答案和解析)
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白: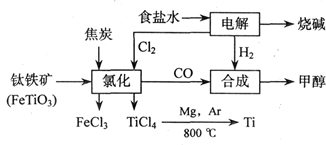
⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应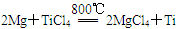 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:

⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)  2C3(g);△H=-a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H=-a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
A.v(C3)=2v(B2) B.容器内压强保持不变
C.v逆(A2)=2v正(B2) D.容器内的密度保持不变

 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。 2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
 Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0| c(CO) | c(CO2) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com