

 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。 2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;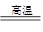 2TiCl4+2FeCl3+6CO;
2TiCl4+2FeCl3+6CO; ,减小③b c
,减小③b c 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。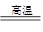 2TiCl4+2FeCl3+6CO。
2TiCl4+2FeCl3+6CO。 。由于是放热反应,所以温度升高,平衡向逆反应方向移动,平衡常数减小。
。由于是放热反应,所以温度升高,平衡向逆反应方向移动,平衡常数减小。

科目:高中化学 来源:不详 题型:单选题
| A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
| B.干冰和冰的硬度不同 |
| C.金刚石的硬度、熔点、沸点都高于晶体硅 |
| D.KF、KCl、KBr、KI的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(石墨,s) = C(金刚石,s) △H>0,所以石墨比金刚石稳定 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生 |
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCl电离产生H+和Cl—,可判断HCl分子中存在离子键 |
| B.Na2O2固体中含有的阴离子与阳离子的个数比为1:1 |
| C.化学键是指使原子或离子相互结合的作用力 |
| D.不同元素组成的多原子分子中的化学键一定全是极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com