
题目列表(包括答案和解析)
2、已知H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是( )
A.Q1<Q3<Q2 B.Ql<Q2<Q3 C.Q1<Q2=Q3 D.Q1=Q2=Q3
1、下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石);ΔH= +119 kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);ΔH= -285.8 kJ/mol
3、羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+ KMnO4+ H2SO4= Fe2(SO4)3+ K2SO4+ MnSO4+ H2O(未配平)),则在上述反应中,羟胺的氧化产物是( )
(A)N2 (B)N2O (C)NO (D)NO2
2. 将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A. 气体A为SO2和H2的混合物
B. 气体A中SO2与H2的体积比为4:1
C. 反应中共消耗Zn 97.5g
D. 反应中共转移电子3mol
1、已知 I-、Fe2+、SO 2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为 Cl-< Fe 2+< H2O 2 < I-< SO 2,则下列反应不能发生的是( )
(A)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ (B)I2+SO2+2H2O=H2SO4+2HI
(C)H2O2+H2SO4=SO2+O2+2H2O (D)2Fe2++I2=2Fe3++2I-
3、设NA为阿伏加德罗常数值,下列叙述中不正确的是( )
A.12.4g白磷晶体中含有的P-P键数是0.6NA
B.2.9g2CaSO4·H2O 含有的结晶水分子数为0.02 NA
C.100 g的98%的浓 H2SO4中所含的硫原子数为2NA
D.2molSO2和1molO2 混合在V2O5存在的条件下密闭容器中加热反应后,容器内物质分子数大于2 NA
2、下列有关阿伏加德罗常数的叙述正确的是( )
(A)标准状况下,以任意比混合的甲烷和丙烷混合气体22.4L所含分子数为NA个
(B)1mol冰醋酸中含有6.02×1023个CH3COO━
(C)电解饱和食盐水时,每得到1molNaOH,在阳极反应的离子就得到1mol电子
(D)标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为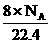
1、NA代表阿伏加德罗常数值,下列说法正确的是( )
(A)9g重水所含有的电子数为5NA
(B)1molMgCl2中含有离子数为NA
(C)7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
(D)1molC10H22分子中共价键总数为31NA
2、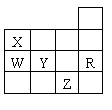 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物沸点比X的氢化物的沸点高
1、X、Y为短周期元素,X原子各电子层的电子数比为1:4:1,它比Y原子多3个电子。下列叙述正确的是:( )
A.X离子半径大于Y离子半径
B.X单质在空气中燃烧可生成两种化合物
C.X、Y形成的化合物与浓硫酸共热可在烧瓶中进行
D.电解X、Y形成的化合物的水溶液可得Y的单质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com