
题目列表(包括答案和解析)
8.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃,80MPa下合成金刚石,具有深远意义。下列说法不正确的是
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.金刚石和石墨互为同素异形体 D.金刚石中含非极性共价键
7.被誉为"太空金属"的钛,在室温下,不跟水、稀盐酸、稀硫酸和稀硝酸等作用,但易溶于氢氟酸,你认为其原因可能是
A.氢氟酸的酸性比其他酸强 B.氢氟酸的氧化性比其他酸强
C.氢氟酸的还原性比其他酸强 D.钛离子易与氟离子形成可溶性难电离物质
6.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是
A.已经制得了IBr、ICl等卤素互化物
B.碘(I2)易溶于KI等碘化物溶液,形成I3-
C.已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3+的化合物
D.已经制得了I2O5等碘的氧化物
5.实验表明,液态时,纯硫酸的导电性强于纯水。已知液态电解质都能像水那样自身电离而建立电离平衡(H2O+H2O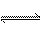 H3O++OH-),且在一定温度下都有各自的离子积常数Kw。问在25℃时,纯硫酸的离子积常数Kw1和水的离子积常数Kw2的关系为
H3O++OH-),且在一定温度下都有各自的离子积常数Kw。问在25℃时,纯硫酸的离子积常数Kw1和水的离子积常数Kw2的关系为
A.Kw1>Kw2 B.Kw1==Kw2 C.Kw1<Kw2 D.无法比较
4.防晒霜中含有能吸收紫外线的防晒剂,例如:对氨基苯甲酸丁酯,它能吸收到达皮肤上99%的紫外线,具有十分理想的防晒效果。下列关于对氨基苯甲酸丁酯的说法正确的是
A.从有机物分类角度看,它属于氨基酸类、酯类、芳香烃类
B.它能与NaOH溶液反应,但不能与盐酸反应
C.甲酸丁酯基(-COOC4H9)有3种不同结构
D.它的分子式为C11H15NO2
3.下列事实不能用化学平衡移动原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.加催化剂使N2和H2在一定的条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制氨气
D.增大压强,有利于SO2和O2反应生成SO3
2.把1 mL0.01 mol/L的盐酸用蒸馏水稀释到1 000L,所得溶液的pH是
A.8 B.7 C.6 D.6.9
1.X、Y、Z 3种元素。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成42个电子的负一价阴离子。下列有关说法正确的是
A.离子半径:X+>Y-
B.原子序数X>Y>Z
C.X、Y、Z均属于短周期元素
D.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物
8.类比递推选择题。
基础1 定性分析选择题
定性分析选择题又称普通选择题,所谓定性分析,就是对化学概念的性质、本质等属性的界定。利用基本概念和基本理论、物质的性质、实验等为素材,考查学生能否准确地运用所掌握的基础知识和基本技能以及教材中已揭示出来的基本概念、基本规律与法则,来分析和解决化学问题。
典型题型与例题
题型一 分析选项型
[例题1] “垃圾是放错了位置的资源”,应该分类回收利用。生活中废纸、废弃的塑料袋、医院的废输液管、废旧轮胎等可以归为一类加以回收利用。它们属于
A.无机物 B.高分子化合物 C.盐类 D.糖类
[解析] 这是一道常识题,废纸是纤维素,废塑料、废输液管、废橡胶制品是合成高分子材料,所以它们都是高分子化合物。所以答案选B
[例题2] 对下列各组离子的叙述正确的是
A.H+、ClO-、Ba2+、HCO3-能在水溶液中大量共存
B.Mg2+、NH4+、Fe2+、NO3-能在酸性溶液中大量共存
C.Fe3+、K+、SCN-、Cl-能大量共存且溶液显红色
D.Na+,NO3-、CO32-、SO32-能在碱性溶液中大量共存
[解析] 我们可以对选项逐一分析进行筛选。A选项H+和HCO3-,不能大量共存;B选项在酸性溶液就有大量H+存在,这样一来H+和NO3-就有强氧化性。会氧化Fe2+:C选项Fe3+和SCN-会反应生成Fe(SCN)3,不能大量共存。所以答案选D。
[例题3] 下列物质久置空气中,其中通过直接观察无法确定其是否变质的是
A.硫酸亚铁晶体 B.亚硫酸钠粉末 C.块状氢氧化钠 D.苯酚晶体
[解析] 硫酸亚铁晶体由浅绿色变成棕黄色;块状氢氧化钠变成粉末状的碳酸钠;
苯酚晶体由白色变成粉红色;亚硫酸钠粉末变成硫酸钠粉末,颜色与状态都没变。所以
答案选B。
[借鉴意义] 这类选择题,我们可以根据已经掌握的概念和原理,在正确理解题意的基础上,对选项进行逐项分析,通过寻找各种不合理的因素,得到正确的答案,方法主要有直选法,筛选法。筛选法又叫排除法或淘汰法。由于这类选择题命题意思多不完整,必须经过选项的补充、限制才能有完整的题意,否则便无法解答。解此类题时常常要用到筛选法、掌握这种方法的要领是以题给条件(或经过加工变形)为"筛子",将选项逐项分析,放弃错误的,留下正确的。其主要类型有:(1)一次筛选(2)分次筛选(3)比较筛选(4)反驳筛选等。比如例题2,3两题就是对选项逐一分析,进行筛选而找到答案的。
题型二 具体代入型
[例题4] A和M为两种元素,已知A位于短周期,巳A2-与M+的电子数之差为8,则下列说法中正确的是
A.A和M原子的电子数之和可能为11 B.A和M的原子序数之差为8
C.A和M的最外层电子数之和为8 D.A和M原子的最外层电子数之差为7
[解析] 根据题意令A为O,M为K,或A为S,B为Na,或A为O,B为Li,可以得出答案为A。
[例题5] 单质X能从盐溶液中置换出单质Y,由此可知
A.当X、Y都是金属时,X一定比Y活泼
B.当X、Y都是非金属时,X一定比Y活泼
C.当X是金属时,Y可能是金属,也可能是非金属
D.当X是非金属时,Y可能是金属,也可能是非金属
[解析] A正确,比如Fe+CuSO4===FeSO4+Cu;B当X、Y都是非金属时,X不一定比Y活泼,比如2NaBrO3+I2=== 2NalO3+Br2。C正确,比如Fe+CuSO4===FeSO4+Cu,2Na+CuSO4+2H2O===Na2SO4+Cu(OH)2++H2↑;D错误。所以答案选AC。
[借鉴意义] 这类题目给出的条件很抽象,看似简单却很容易出错,若选择具体
的事物作为研究对象,把抽象的问题具体化,往往会收到意想不到的效果,方法主要有
具体代入法或代入特例反驳法、比如例题4就找出符合题意的具体物质代入进行验证
判断,得到正确的答案。例题5就是代入特例反驳法。
题型三 本质特征型
[例题6] 5mL物质的量浓度为18mol/L的硫酸中加入足量铜片并加热,充分反应。下列有关说法中正确的是
A.有0.09mol的硫酸被还原 B.有0.045mol的硫酸被还原
C.充分反应后体系无硫酸剩余 D.消耗的铜的质量,一定少于2.88g
[解析] 解答此题容易陷入根据化学方程式计算的误区,必须抓住问题的本质:强氧化性是浓硫酸的特性。随反应的进行,浓硫酸变稀,氧化性变弱消失,反应将终止,因此参与反应的硫酸的物质的量-定少于0.09mol,被还原的硫酸一定少于0.045mol,同样,参与反应的铜的质量也一定少于2.88 g。因此正确答案为D。类似的问题还有MnO2与浓盐酸,Cu与浓硝酸或稀硝酸反应等。
[例题7] 由于工业的发展,水资源污染日趋严重,水的净化处理一直是受到高度重视的研究课题。某些含Al3+、Fe3+的化学试剂可用于净水,如聚合硫酸铁,其化学式为[Fe2(OH)m(SO4)3 - ]n,式中m不可能为
A.6 B.4 C.3 D.2
[解析] 题给物质的化学式很复杂,我们善于抓住问题的本质,就是3-≠0,即m≠6,所以选A。抓住了题目所提供的本质特征,貌似很复杂的问题可以迎刃而解。
[借鉴意义] 要善于抓住题目所提供的各种本质特征(如:反应本质特征,物质结构特征,数值特征,位置特征等),弱化或去掉干扰信息,实现问题的转换和突破,就好比俗语说:"打蛇要打七寸",分析问题就是要找到问题的实质。比如例题7认识到硫酸根的个数不能为零,所以m≠6。
基础1题型训练
7.评价配对选择题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com