
题目列表(包括答案和解析)
4.中央电视台新闻栏目2006年5月14日报道齐齐哈尔第二制药有限公司生产的假药事件,
“齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4-二恶烷(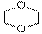 )等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
)等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
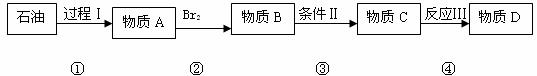
请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为 。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是 ,该反应属于 (添反应类型)。写出B可能生成E的化学方程式: 。
(4)物质D是二甘醇,则合成路线中的物质A、B、C的结构简式分别是:
A: B: C:
(5)反应Ⅲ的化学方程式为: 。
(6) 写出二甘醇制备1,4-二恶烷的化学方程式: 。
答案:(1)A (2)裂解;(3)NaOH水溶液,取代反应;
CH2BrCH2Br +
2NaOH 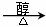 HC≡CH↑+ 2 NaBr (3分
HC≡CH↑+ 2 NaBr (3分
(4) A:CH2=CH2,B:Br-CH2-CH2-Br,C:HO-CH2-CH2-OH。(各1分共3分)
(5)2HO-CH2-CH2-OH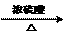 2HO-CH2-CH2-O-CH2-CH2-OH+H2O(3分)
2HO-CH2-CH2-O-CH2-CH2-OH+H2O(3分)
(6)HO-CH2-CH2-O-CH2-CH2-OH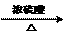
 +H2O (3分)
+H2O (3分)
解析:本题涉及到石油的裂解、有机反应类型、有机反应条件的选择等方面的知识。从产物可以看出本题的物质的转化关系,从而容易得到有机物的结构简式。D是HO-CH2-CH2-O-CH2-CH2-OH,C为HO-CH2-CH2-OH,B为Br-CH2-CH2-Br,A为CH2=CH2。知道了具体的物质其他问题就可以解决。
3.实验室用Zn粒和盐酸反应制H2,其中含酸雾、水气、硫化氢及少量氧气等杂质气体,某同学设计了以下几种装置,按一定顺序连接,气体通过时,达到每一装置除去一种气体的目的。
(1)它们连接的顺序为 ;

(2)除去H2S的离子方程式为 ;
(3)除去O2观察到的现象为 。
解析:第一个洗气瓶中冷水可用来吸收氯化氢气体;第二个洗气瓶用来干燥;第三个洗气瓶可除去硫化氢气体;第四个洗气瓶可除去少量的氧气。在连接时还要考虑先除杂后干燥的原则。
答案:(1)a→b→e→f→g→h→d→c;(2)H2S+Cu2+= CuS↓+2H+;(3)溶液由浅绿色逐渐变成黄色
2.市场上出售的“热敷带”的主要成分是铁屑、碳粉、木屑、少量的氯化钠、水等。“热敷带”启用之前用塑料袋密封,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会产生大量铁锈。
(1)“热敷带”放热的原理是:______________________________________________
(2)碳粉的作用是: 氯化钠的作用是:_____________________________
(3)有关电极反应是:________________________________________________________
总反应为:_____________________________________________________________
答案: 1利用原电池原理
2充当原电池的正极;充当原电池的电解质溶液
3正极:2H2O+O2+4e-=4OH_ 负极:Fe-2e-=Fe2+
总:4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3=Fe2O3+3H2O
1.有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素。
(1)A的名称是____________,B位于周期表中第_________周期________族,C的原子结构示意图是________________。
(2)E的单质颜色是____________________。
(3)A元素与D元素形成化合物的电子式是__________________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是_____________________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是_________,酸性最强的化学式是_______________,气态氢化物最稳定的化学式是______________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是:___________________________________________
解析:此题必须根据原子结构,元素周期表的知识,结合相关已知条件,并利用短周期元素原子结构的特征规律以及某些元素的特征性质,才能推算出原子序数,判定元素在周期表中的位置。进而顺利作答本题。此题综合性较强,考察的知识面较广,在高考试题中经常出现。这就要求学生在复习的过程中,必须注意知识间的相互联系。具体解答为:
据①知A、B、C均为第3周期的金属元素(只有Na、Mg、Al),且原子半径A>B>C,则A、B、C分别为Na、Mg、Al;据②可知D、E均为VIIA族元素,D的单质为液体,则D为Br,E的单质为固体,则E为I;
据③知F为He,据④知G为氟。
答案:(1)钠
3 ⅡA 
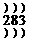 (2)紫黑色 (3)
(2)紫黑色 (3)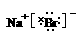
(4)2F2+2H2O 4HF+O2(5)He (6)NaOH HBrO4 HF
4HF+O2(5)He (6)NaOH HBrO4 HF
(7)Al(OH)3+OH- AlO2-+2H2O
AlO2-+2H2O
20.化学反应经常伴随着颜色变化,下列有关反映的颜色变化正确的是:
①蛋白质遇浓硝酸-黄色②淀粉溶液遇单质碘-蓝色③溴化银见光分解-白色④热的氧化铜遇乙醇-绿色⑤新制氯水久置后-无色⑥苯酚在空气中氧化-粉红色 ( )
A.①②③⑤ B.② ④⑤ C.①②⑤⑥ D. ②③ ⑥
答案:C
解析:①蛋白质遇浓硝酸-黄色,正确;②淀粉溶液遇单质碘-蓝色,正确;③溴化银见光分解不是白色,而是黑色;④热的氧化铜遇乙醇不是绿色,而是红色;⑤新制氯水久置后-无色,正确;⑥苯酚在空气中氧化-粉红色,正确;故正确答案为C.
非选择题
19.下列实验方法:①用渗析法分离蛋白质和葡萄糖的混合液 ②用盐析法分离出皂化反应产生的高级脂肪酸钠 ③用蒸馏法分离C2H5OH与H2O的混合物 ④用分液法分离H2O和C2H5Br的混合物。你认为上述方法( )
A. 只有①不正确 B. ②③不正确 C. 只有③④正确 D. 全部正确
解析:①中蛋白质溶液是一种胶体,而葡萄糖溶液不是,可用渗析法进行分离;②中向混合液中加入食盐使高级脂肪酸钠的溶解度降低而析出从而达到分离的目的;③中乙醇和水的沸点不同,可用蒸馏法分离;④中溴乙烷密度比水大,难溶于水,可用分液法进行分离。
答案:D
18.下列各项中按由大到小的顺序排列的是
A.等体积等pH的盐酸、醋酸和稀硝酸与足量的镁粉反应产生的氢气的体积
B.等体积等浓度的碳酸钠、碳酸氢钠、氯化铵和NaHSO4溶液的pH
C. 已知0.1mol•L-1的H2A溶液的pH=3,Na2A溶液中的Na+、A2-、HA-、H+、OH-的物质的量浓度
D. 常温下,pH=7的NH4Cl与氨水的混合溶液中Cl-、NH4+、OH-、H+的物质的量浓度
答案:B。
解析:A项中稀硝酸具有强氧化性,与镁粉反应不会产生氢气,盐酸是强酸、醋酸是弱酸,若pH相等则一定是醋酸的浓度大,所以等体积等pH的醋酸与足量的镁粉反应产生的氢气更多;硫酸氢钠电离方程式为:NaHSO4=Na++H++SO42-,所以其溶液为强酸性,氯化铵是强酸弱碱盐,所以其水解后溶液呈弱酸性,碳酸钠和碳酸氢钠都可以水解使溶液呈弱碱性,但碳酸钠是CO32-的水解,碳酸氢钠是HCO3-的水解,碳酸钠水解程度更大,所以碳酸钠比碳酸氢钠碱性稍强;若H2A是强酸,则0.1mol•L-1的H2A溶液的pH=0.7,与已知条件矛盾,所以H2A并不是强酸,而是弱酸,则Na2A溶液中存在若干电离过程,按主次关系排列如下:
Na2A=2Na++A2-,A2-+H2O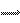 HA-+OH-, HA-+H2O
HA-+OH-, HA-+H2O  H2A+OH-,H2O
H2A+OH-,H2O  H++OH-,则大小关系为:c(Na+)> c(A2-)>c(OH-)>
c(HA-)>c(H+);
pH=7的NH4Cl与氨水的混合溶液中有电荷守恒关系:c(Cl-)+ c(OH-)=c(NH4+)+c(H+),所以当pH=7时,c(H+)=c(OH-)
,则有:c(Cl-)=c(NH4+),即:c(Cl-)=c(NH4+)>
c(H+)=c(OH-)。
H++OH-,则大小关系为:c(Na+)> c(A2-)>c(OH-)>
c(HA-)>c(H+);
pH=7的NH4Cl与氨水的混合溶液中有电荷守恒关系:c(Cl-)+ c(OH-)=c(NH4+)+c(H+),所以当pH=7时,c(H+)=c(OH-)
,则有:c(Cl-)=c(NH4+),即:c(Cl-)=c(NH4+)>
c(H+)=c(OH-)。
17.实验室里需用480mL 0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )。
A.称取7.68g硫酸铜,加入 500mL水 B.称取12.0g胆矾配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水 D.称取12.5g胆矾配成500mL溶液
提示: A.C选项中加入500mL水,最后溶液的体积不止500mL,胆矾的化学式为CuSO4·5H2O,通过计算不难知D选项符合题意。
16.被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示。有关该化合物的叙述正确的是( )
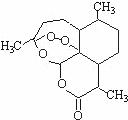
A.分子式为:C16H22O5
B.该化合物在一定条件下不能与NaOH溶液反应
C.该化合物中含有过氧键,一定条件下有氧化性
D.青蒿素与维生素一样是水溶性的
答案:C。
解析:选项A从结构式上可以看出该化合物的分子式是C15H22O5;该化合物含有一个酯基,可发生水解,所以可以和NaOH溶液反应;化合物中含有过氧键,在一定的条件下过氧键能与氢结合成双氧水,具有氧化性;由于分子比较大又有酯基,所以难溶于水。
15.由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是
A.水分子的化学性质改变 B.水分子中氢氧键缩短
C.水分子间的作用力减小 D.水分子间结构、物理性质改变
答案:D。
解析:小分子团水仍是以分子为基本单位组成的聚集体,所以分子结构并没有改变,分子中的氢氧键并没有缩短,化学性质更不会改变。它改变的是分子间的结构,分子间作用力增强,物理性质改变。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com