
题目列表(包括答案和解析)
24.(1)画图略,
(2)请提出可提高其反应速率且增大NH3生成量的建议:升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系。
(3) ①该条件下N2的平衡转化率:66.7%
②该条件下反应2NH3(g) ==== N2(g) +3H2(g)的平衡常数为0.005
①所以N2的平衡转化率=(0.3-0.1)/0.3*100%=66.7%
②反应2NH3(g) ==== N2(g) +3H2(g)的平衡常数K= c(N2)* c(H2)^3/ c(NH3)^2=0.005
3、工业合成氨的反应为N2(g)+3H2(g) ? 2NH3(g)。设在容积为2.0L的密
闭容器中充入0.60mol N2(g)和1.60 mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为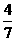 。计算
。计算
① 该条件下N2的平衡转化率;
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
2.与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提
 高其反应速率且增大NH3生成量的建议: 。
高其反应速率且增大NH3生成量的建议: 。
1.请在答题卡的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程
中体系能量变化示意图,并进行必要标注。
24.(12分)
科学家一直致力研究常温、常压下“人工围氮”的新方法。曾有实验报道:在常温、常压、学照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h):
|
T/K |
303 |
313 |
323 |
353 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(1)=2NH3(g)+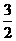 O2(g) ΔH=+765.2kJ·mol-1
O2(g) ΔH=+765.2kJ·mol-1
回答下列问题:
23.下列各组离子一定能大量共存的是 (B )
A.在含有大量的Fe3+溶液中:NH4+ 、Na+ 、Cl-、SCN-
B.在pH=14的溶液中:Na+、K+、AlO2-、CO32-
C.在[H+]=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、ClO-
22、下列离子方程式正确的是D
A.NaHCO3溶液中加入少量的石灰水 HCO3-+ Ca2+ + OH-=CaCO3↓+H2O
B.向氯化铁溶液中通入硫化氢气体 3Fe3+ + H2S = 2Fe2+ + FeS↓+2H+
C.氯化铝溶液中加入过量氨水 Al3+ + 4 OH- = AlO2-+ 2H2O
D.氨水中通入过量SO2 NH3·H2O + SO2 = HSO3- + NH4+
21.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的判断结论正确的是
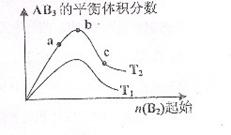 A.反应速率a>b>c
A.反应速率a>b>c
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应是放热反应
D.达到平衡时,AB3的物质的量大小为:c>b>a
20.在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表

上述四种情况达到平衡后,n(CO)的大小顺序是A
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
19、向三份0.1mol,L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2因体(忽略溶液体积变化),则CH3COO-浓度的变化依次为C
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com