
题目列表(包括答案和解析)
3.下列关于Na2O2的叙述正确的是 ( )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只作氧化剂
C.用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色k+s-5#u

D.Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出
2.下列说法正确的是 ( )
A.Na2O2是碱性氧化物,能和水反应生成NaOH k+s-5#u

B.Na在空气中的燃烧需要预先加热,所以该反应为吸热反应
C.NaHCO3不稳定,在一定条件下可以转化成Na2CO3 k+s-5#u

D.Na和盐不能发生置换反应
1.2008全国各地两会政协委员聚焦食品安全,食品添加剂与人民的生活息息相关,不用食
品添加剂的食品几乎没有。下列不属于违反使用食品添加剂是 ( )
A.“面包中加黑色竹炭 B.添加OMP与IGF-1物质“特仑苏”牛奶。
C.焙制糕点中加小苏打 D.含有甲醛的鱿鱼
21.(8分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是________溶液,乙是_________溶液。
(2)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为___________。
(3)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是____________________________。k+s-5#u

20.(13分)(Ⅰ).下面是中学化学实验中常见的几种定量仪器:
a、量筒b、容量瓶c、滴定管d、托盘天平e、温度计k+s-5#u 
(1)其中标示出仪器使用温度的是_____________(填写编号);
(2)使用前要检查仪器是否漏液的是____________________(填写编号);k+s-5#u

(Ⅱ).实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号)
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒 ⑨酸式滴定管
(2)若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?k+s-5#u

答:
(Ⅲ).实验室配制500ml 0.2mol·L-1的FeSO4溶液,实际操作有:①在天平上称量一定量的绿矾(FeSO4·7H2O),放入烧杯,加水溶解;②把制得的溶液小心地注入500ml容量瓶中;③继续向容量瓶中加水离刻度线1-2cm处,改用胶头滴管加水至刻度线;④将烧杯和玻璃棒洗涤2-3次,并将每次洗涤液也转入容量瓶;⑤将容量瓶的塞子塞紧,摇匀。填下列空白:
(1)称量绿矾的质量是 ;
(2)正确的操作顺序是 ;
(3)定容时,若俯视液面,会使溶液浓度 ;
(4)若没有操作④,结果会使溶液浓度 ;
19.(9分)有两份溶液,其中所含溶质相同有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol。根据下表信息,回答有关问题:
|
|
溶质的质量分数 |
溶液的密度(g·cm-3) |
|
第一份溶液 |
ω1 |
ρ1 |
|
第二份溶液 |
ω2 |
ρ2 |
(1)第一份溶液中,溶质的物质的量浓度为 。
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3= 。
(3)若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小?
①
②
。k+s-5#u 
18.(6分)A、B、C均为可溶于水的白色固体,可能含有阴、阳离子分别是:k+s-5#u

|
阳离子 |
Ba2+ Ca2+ K+ NH4+ |
|
阴离子 |
NO3- Cl- CO32- OH- SO42- |
为了鉴定其中的离子,现在进行如下实验,根据实验现象,填写下列表格。
实验①:将一定量的A、B、C三者粉末混合加入水中,振荡得到无色溶液和白色沉淀,进行过滤、洗涤、干燥、称量得到29.7g。用pH计测得溶液的pH=7.0(常温条件)。
实验②:向实验①的悬浊液中加过量的硝酸,白色沉淀全部消失,并有气泡产生,产生气体的体积4.48L(标况)。k+s-5#u 
实验③:向实验②所得的溶液中滴入过量的AgNO3溶液,得到白色沉淀进行过滤、洗涤、干燥、称量得到28.7g。
试回答下列问题:
(1)根据实验①可以排除的离子是
k+s-5#u 
(2)根据实验①②还可以排除的离子是
(3)根据实验①②③试确定K+是否存在? ,判断的理由是
。
(4)一定量的A、B、C三者粉末可能组成及物质的量是
17.(12分)现有如下药品和装置:w克锌片(w < 1 g)、稀H2SO4、水,设计一个实验,测Zn的相对原子质量(假定实验是在标准状况下进行的)。
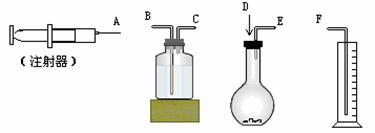
(1)写出该反应的化学方程式 ;
(2)所用装置的连接顺序为(填接口字母)
(3)实验时用稀硫酸而不用稀硝酸,其理由是
;
(4)若量筒中收集到的水为V mL,反应时加入的稀硫酸为10 mL,实验结束后导管内的水按1 mL计算,则反应产生的氢气为 mL,Zn的相对原子质量的数学表达式为 ;
(5)假如锌片含不与酸反应的杂质,实验测得的锌的相对原子质量可能比真实值(填“偏大”、“偏小”、“不影响”,下同) ;若气密性不好,测得值 ;Zn与稀H2SO4的反应是放热的,若立即读数,会使测定的结果 。
16.(7分)某一反应体系中有反应物和生成物共4种物质:NH4Cl、Cl2、NH3、N2。已知N2为生成物体。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1)该反应的氧化产物的摩尔质量是
(2)写出该反应配平的化学方程式:
(3)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(4)阿伏加德罗数常数为(用含a、b的代数式表示)
。k+s-5#u

15.现有44gMg,Al、Zn,Fe多种活泼金属粉末的混合物与1L含有一定质量的20%硫酸溶液恰好完全反应,得到无水盐140g.则下列说法正确的是 ( )
A.电子转移为1mol B.生成的气体体积(标准状况)为22.4 L
C.硫酸溶液的质量为540g
D.硫酸物质的量浓度为2mol/L k+s-5#u 
第Ⅱ卷(非选择题 55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com