
题目列表(包括答案和解析)
2.已知:HCN的结构为H-C≡N;
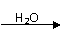
①R-CN RCOOH,
 ②R-Cl+CN-
R-CN+Cl-(R为烃基)。
②R-Cl+CN-
R-CN+Cl-(R为烃基)。
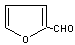 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:

⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式
。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
1.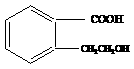 为有机物A的结构简式,可以通过不同的反应制得下列物质。
为有机物A的结构简式,可以通过不同的反应制得下列物质。
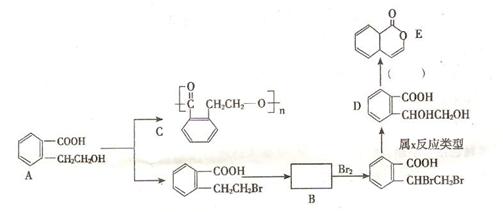
(1) 写出A → C的化学方程式: 。
(2) 推断B物质的结构简式 ;X反应类型是 ;由 D → E 所需的试剂是 。
(3) R物质属于A 的同分异构体,其性质如下:
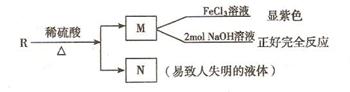
试写出符合条件的R的同分异构体的结构简式(任写两种) : ; 。
5. ⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I- == 2Fe2+ + I2
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
2010年高考化学第二轮复习20分钟专题突破(26)
专题 有机推断
4. (1)SO2 NH4+
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- 4NH3+3Cl2=NCl3+3NH4Cl
(3)饱和H水溶液中存在平衡:Cl2+H2O H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
3.(1)SO2 NH4+
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- 4NH3+3Cl2=NCl3+3NH4Cl
(3)饱和H水溶液中存在平衡:Cl2+H2O H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
2. (1)Fe H2O
(2)作半导体材料、制芯片等

 (3)①2Mg+CO2
(3)①2Mg+CO2 2MgO+C
 ④C+H2O(g)
④C+H2O(g) CO+H2
⑤SiO2+2C
Si+2CO
1. (1)Al2O3+6H+ === 2Al3++3H2O Al2O3+2OH-+3H2O === 2[Al(OH)4]-
 (2)Al3++3H2O Al(OH)3(胶体)+3H+
(2)Al3++3H2O Al(OH)3(胶体)+3H+
(3)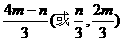
(4)O2+2H2O+4e-=== 4OH- 2NA
5.根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
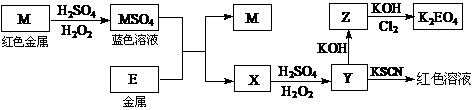
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
 ⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: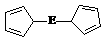 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
参考答案
4.已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。

(1)写出B的电子式 ,D的结构简式 。
(2)写出A与B反应的化学方程式 。
(3)如对气体G进行加压操作,产生的现象是 。
(4)写出下列反应的离子方程式:
①在A溶液中加入M 。
②向A溶液中加入过量NaOH溶液,并加热 。
3.下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。

已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式 ;G的水溶液中,最多的阳离子是 。
(2)写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com