
题目列表(包括答案和解析)
1.C 2.B 3.A 4.A 5.C 6.B
8. 铜是重要的工业原材料,现有Cu、Cu2O、CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入1L0.6mol·L-1HNO3溶液刚好使其溶解,同时收集到2.24LNO气体(标准状况)。通过计算回答下列问题(写出解题过程)
(1)产物中硝酸铜的物质的量。
(2)如混合物中Cu的物质的量为x,则x的取值范围为
参考答案
7.实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及其物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是____ ____溶液,其物质的量浓度为 mol·L-1。
(2)实验②中所发生反应的离子方程式为_______________________ _____ 。
6.下列叙述的两个量,一定相等的是
A.0.1mol·L-1NaCl与0.05mol·L-1Na2CO3溶液中的Na+离子数目
B.质量相等的金刚石和C60中的碳原子数目
C.标准状况下等体积的SO2与SO3的分子数目
D.pH都为3的稀盐酸与FeCl3溶液中,由水电离产生的H+离子数目
5.将标准状况下的某气体(摩尔质量为Mg•mol-1)溶于ag水中,所得到溶液的密度为bg•cm-3,物质的量浓度为cmol•L-1,则该气体溶入水中的体积是 ( )
A.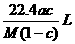 B.
B.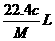 C.
C.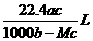 D.
D.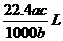
4.用98%的浓H2SO4(密度为1.84g/ml)配制的1mol·L-1的稀H2SO4100ml,配制过程中可能用到下列仪器:①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒,按使用出现的先后顺序排列正确的是 ( )
A.②⑥③⑦⑤ B.④③⑤⑦⑥ C.①③⑦⑤⑥ D.②⑤⑦⑥
3. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·mol-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mL B.45mL C.30mL D.15mL
2.在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿佛加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为 ( )
A.2mol·L-1 B.2.5 mol·L-1
C.5 mol·L-1 D.7.5 mol·L-1
1.NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.高温下60g SiO2与足量纯碱反应,最多可释放出2NA个气体分子
B.1mol C5H12分子中共价键总数为13NA
C.78g Na2O2固体与H2O反应转移的电子数为NA
D.标准状况下,2.24L NH3和CH4的混合气体,所含电子总数为2NA
6. (1)取红色和白色固体粉末混合均匀后,若混合物的颜色不为灰绿色,则证明观点不正确。(2分)盐酸或稀硫酸、KSCN溶液。
(2)Fe(OH)2 易被氧化成灰绿色的Fe3(OH)3 Fe2+、Fe3+。
①向盛有蒸馏水的烧杯中加入一定量的硫酸,再将样品置于其中,搅拌溶解;然后加入过量的还原铁粉,反应为:2Fe3++Fe=3Fe3+,搅拌、静置,上层清液即为所要配置的FeSO4溶液。
②O2+2H2O+4e-=4OH-
否(1分)产生的Fe(OH)2随即就被空气氧化为Fe(OH)3
③打开胶管夹C,使反应进行一段时间后关闭C
④2H++2e-=H2↑ B
2010年高考化学第二轮复习20分钟专题突破(12)
专题 物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com