
题目列表(包括答案和解析)
1.C 2.B 3.C 4.B 5.C 6.D 7.AC 8.BC 9.A
3.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
I |
|
|
|
B |
|
|
|
|
|
|
|
C |
D |
J |
|
G |
|
E |
|
|
|
|
|
|
|
|
H |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
讲析:首先根据实验得出的性质,可将十种元素大致划分为四组:A和E,B、F、G和H,C和I,D和J。再根据相对原子质量的大小,排出它们是左右关系还是上下关系,便不难得出答案。
检测提高
1.C 2.D
讲析:1.物质熔点比较与晶体类型有关;主族元素最高正价=族序数;非金属元素气态氢化物水溶液的酸性应分同周期和同主族两种情况来讨论;非金属元素对应阴离子的还原性与其非金属性相反,而最高价氧化物的水化物的酸性与其非金属性相同。 2.根据化学式分析化合价为+3、-1或+6、-2,再定位讨论;另外要考虑特例如PH3、NH3和PCl3。
14.⑴98 ⑵ 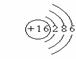 讲析:设R的化合价为-x,R的相对原子质量为y。联列方程组讨论分析得出结论。
讲析:设R的化合价为-x,R的相对原子质量为y。联列方程组讨论分析得出结论。
第9课时 (B卷)
 纠错训练
纠错训练
13. ⑴H N O Na ⑵
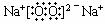 ⑶NH4NO3
⑶NH4NO3
NH4+
+ OH- 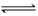 NH3↑ +
H2O
NH3↑ +
H2O
讲析:定位讨论,X必在第一周期为H,W则必在第三周期为Na,Y、Z在第二周期。
11.⑴188O ⑵VIII ⑶17 ⑷六、七
|
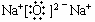 12. ⑴ CaF2 , CS2 ⑵ MgS ⑶ NaOH 或 LiHS ⑷ H2b-mXOb
⑸ KCl 或CaCl2 讲析: BeCl2 的化合物类型不作要求。
12. ⑴ CaF2 , CS2 ⑵ MgS ⑶ NaOH 或 LiHS ⑷ H2b-mXOb
⑸ KCl 或CaCl2 讲析: BeCl2 的化合物类型不作要求。1.过渡元素的原子最外层电子数一般为2,Mn的化合价可以是+7价。 3.第四周期第IIA族元素为Ca。 4.注意各周期中所包含元素的种类不一样 。 5. 砷是氮族元素之一,从磷元素的性质可推出砷的原子结构及对应化合物的性质。 6.元素非金属性与原子得电子能力、元素气态氢化物的稳定性、元素在周期表中的位置等因素有关。 7. 第3列为ⅢB族,包括镧系和锕系元素,故元素种类最多,第14列是ⅣA族,包括C元素,而含C元素的化合物种类最多,第10列为Ⅷ族,第12列为ⅡB族,都属过渡元素,都是金属元素,因过渡元素(第3列至第12列)原子的最外层电子数绝大部分为2个,不全在第2列。随原子序数的递增,第17列(卤族)元素的单质熔点依次升高。 8.由三种元素最高价氧化物的水化物的分子式知X、Y、Z的最高正价分别为+7、+6、+5,推知它们分别位于第ⅦA、ⅥA、ⅤA,由同一周期元素性质的递变规律可确定符合题意的选项。 9. 熔点比较可根据金属钠易熔化、氧化镁可作耐火材料来分析,另外碳酸钠不易分解。
1.B 2.C 3.CD 4.A 5.BC 6.D 7.AB 8.A 9.B 10.A
讲析:
3. (1)CH4 、NH3 ,H2S 、H Cl (2)>、>、> (3)CF Cl3 或 CF3 Cl (4)使大气臭氧层出现空洞 a
讲析: ⑴根据元素周期律,非金属性越强,氢化物的稳定性越大。⑵根据已知化合物的毒性,自己总结出规律:相同类型的化合物,相对分子质量越大,其化合物的毒性也越大。应用此规律可得出结论。
新活题网站
1.AD 2.A
 讲析:1.对于原子,其核外电子层数等于该元素所在的周期数,而离子则不然;同一元素的各种同位素的化学性质均相同,但物理性质不同。 2.阳离子半径:Li+〈 Na+〈 K+〈 Cs+;阴离子半径:F-〈 Cl-〈 Br-〈 I-。
讲析:1.对于原子,其核外电子层数等于该元素所在的周期数,而离子则不然;同一元素的各种同位素的化学性质均相同,但物理性质不同。 2.阳离子半径:Li+〈 Na+〈 K+〈 Cs+;阴离子半径:F-〈 Cl-〈 Br-〈 I-。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com