
题目列表(包括答案和解析)
14.1mol气态钠离子和1mol气态氯离子结合生成1mol 氯化钠晶体所释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是 。
A.Na+(g) + Cl-(g) = NaCl(s) ΔH
B.Na(s) +1/2Cl2(g)=NaCl(s) ΔH1
C.Na(s)= Na(g) ΔH2
D.Na(g) -e-= Na+(g) ΔH3
E.1/2Cl2(g) =Cl(g) ΔH4
F.Cl(g)+ e-= Cl-(g) ΔH5
(2)写出ΔH1与ΔH、ΔH2、ΔH3、ΔH4、ΔH5之间的关系式 。
已知氧化亚铁晶体结构跟氯化钠晶体结构相似,则:
(3)氧化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子的个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为ρg/cm3,则氧化亚铁晶体中二价铁离子与氧离子之间最近距离是 cm(用代数式表示)。
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将 (填“减少”、“增多”或“保持不变”)。
12.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
 13.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
13.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
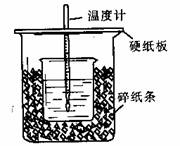
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”),简述理由
。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”、“无影响”);用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”、“无影响”)。
11.已知X和Y是短周期元素中的同族单质, W、V是化合物,它们有如下反应(式中系数及反应条件均略去):X + W =Y + V,试写出符合上述题意并满足下列要求的化学方程式:
① W是水 ;
② W、V均是氧化物 。
10.把试管放入盛有25℃时饱和石灰水的烧杯中,试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是 ;
(2)产生上述现象的原因是 ;
(3)写出有关反应的离子方程式 ;
(4)由实验推知,氯化镁溶液和氢气的总能量 (填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
9.在适当的温度和压强下,4体积某气体化合物完全分解后产生1体积磷蒸气和6体积氢气,由此可以推断该气态化合物分子式是 ,该分解反应的化学方程为 。
8.已知下列物质的标准生成热:Fe3O4(s)为1117.13KJ/mol,CO (g) 为110.54 KJ/mol,CO2(g)为393.51 KJ/mol,则反应:Fe3O4(s)+4 CO (g)=3 Fe(s)+4 CO2(g) ;
A. ΔH= ( )
A.-14.75 KJ/mol B. +14.75 KJ/mol
C.-110.54 KJ/mol D.-29.5 KJ/mol
7.物质的生成热可定义为由稳定单质生成1mol物质所放出的热量,如二氧化碳气体的生成热就是C(s)+O2(g)=CO2(g)的反应热已知下列几种物质的生成热:葡萄糖-1259 KJ/mol,H2O-285.8 KJ/mol,CO2-393.5 KJ/mol。则1Kg葡萄糖在人体内完全氧化成二氧化碳气体和液态水,最多可提供的能量为 ( )
A.3225 KJ B.2816 KJ
C.6999 KJ D.15645 KJ
6.已知H-H键能为436 KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3 ΔH=-92.4 KJ/mol,则N≡N键的键能是 ( )
A.431 KJ/mol B.946 KJ/mol
 C.649 KJ/mol D.869 KJ/mol
C.649 KJ/mol D.869 KJ/mol
5.已知下列两个热化学方程式:
C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体,在氧气中完全燃烧,共放出63.53kJ的热量。则炭与氢气的物质的量之比是 ( )
A.1:1 B.1:2 C.2:3 D.3:2
4.一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量( )
A.0.5Q B.Q C.2Q D.5Q
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com