
题目列表(包括答案和解析)
4. PH为3的FeCl3溶液,pH为11的Na2CO3溶液和pH为3的盐酸中由水电离出来的H+的浓度分别为:C1、C2、C3它们之间的关系是
A.C1<C2<C3
B.C1=C2>C3
C.C1>C2>C3
D.无法判断
PH为3的FeCl3溶液,pH为11的Na2CO3溶液和pH为3的盐酸中由水电离出来的H+的浓度分别为:C1、C2、C3它们之间的关系是
A.C1<C2<C3
B.C1=C2>C3
C.C1>C2>C3
D.无法判断
3. 20ml 1mol/L醋酸溶液与40ml 0.5mol/L烧碱溶液混合后,溶液中离子浓度的关系正确的是
A.[Na+]>[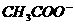 ]>[
]>[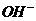 ]>[H+] B.[Na+]>[
]>[H+] B.[Na+]>[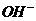 ]>[H+]>[
]>[H+]>[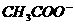 ]
]
C.[Na+]+[H+]>[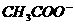 ]+[
]+[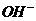 ] D.[Na+]+[H+]=[
] D.[Na+]+[H+]=[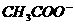 ]+[
]+[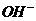 ]
]
2. 说明氨水是弱碱的事实是:
A.氨水具有挥发性。 B.1mol/L氨水溶液的pH=10
 C.1mol/L NH4Cl溶液的pH=5。 D.氨水与AlCl3溶液反应生成Al(OH)3沉淀
C.1mol/L NH4Cl溶液的pH=5。 D.氨水与AlCl3溶液反应生成Al(OH)3沉淀
1. 使0.1mol/L K2CO3溶液中[K+]==2[ ],应采取的措施是
],应采取的措施是
A.加少量盐酸 B.加适量KOH C.加适量水 D.加适量NaOH
16.(15分)如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
 (4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是
。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是
。
15.(10分)下图是目前世界上比较先进的电解法制烧碱技术-阳离子交换膜法的示意图。
(1)精制饱和食盐水从 口加入,从另一口加入水(含少量NaOH)。水中加入NaOH的作用是 ;制得的烧碱溶液从 口导出。
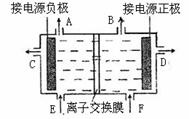 (2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入
试剂的合理顺序为 (填字母)。
a.先加NaOH,再加Na2CO3,最后加钡试剂;
b.先加NaOH,再加钡试剂,最后加Na2CO3;
c.先加钡试剂,再加Na2CO3,最后加NaOH。
(3)现有1000mL食盐水,用石墨电极电解。当阴极产生气体的体积为112mL(标准状况)时停止电解,阳极的电极反应式为_______________________,电解后,溶液在常温下的pH约为_____。
14.(2008.12东城区七所示范校第一次联考)(8分)
如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹,电源a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电, 电解一段时间后A、B中均有气体如图所示。

(1)电源的a极为 (填正、负极)。
(2)在湿的Na2SO4滤纸条中心滴KMnO4液滴,现象是 。
(3)写出A中电极反应式 。
 (4)若电解一段时间后A、B中均有气体包围电极。此时切断K2、K3,闭合K1电流表的指针偏转,此时B极电极反应式为
。
(4)若电解一段时间后A、B中均有气体包围电极。此时切断K2、K3,闭合K1电流表的指针偏转,此时B极电极反应式为
。
13.(安徽省皖南八校2009届高三第一次联考化学试卷)(8分)
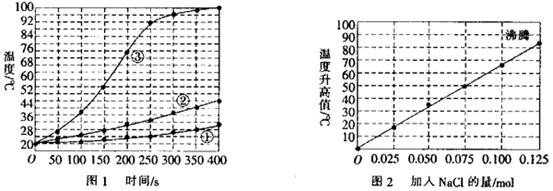
士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠粉术,使用时加入水与其中的镁反应放出热量。下面是在室温下对泼产品的两个探究实验:
[实验I]向加有等量水的三个相同隔热容器中分别加入下列各组物质,结果参见下图l。
① 镁条、
镁条、 铁粉、
铁粉、 氯化钠粉末;
氯化钠粉末;
②将 镁条剪成100份、
镁条剪成100份、 铁粉、
铁粉、 氯化钠粉末;
氯化钠粉末;
③ 镁粉、
镁粉、 铁粉、
铁粉、 氯化钠粉末。
氯化钠粉末。
[实验2]向加有100 mL水的多个相同隔热容器中分别加入由 镁粉、
镁粉、 铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15 min时记录温度升高的幅度,参见上图2。
铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15 min时记录温度升高的幅度,参见上图2。

请同答下列问题:
(1)实验l证实了该反应的反应速率与 有关。
(2)实验2中当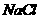 的用量大于
的用量大于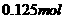 时,实验就无须再做的原因是 (填字母)。
时,实验就无须再做的原因是 (填字母)。
A.加入更多的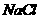 不再增加反应速率 B.加入
不再增加反应速率 B.加入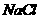 反而会降低反应速率
反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加人更多的铁粉来提高温度
(3)如果在实验2中加入了 的
的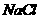 ,则第
,则第 时混合物的温度最接近于
(填字母)。
时混合物的温度最接近于
(填字母)。
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、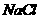 能使反应速率加快的原因是
。
能使反应速率加快的原因是
。
12.(09海南卷 15)(10分)
15)(10分)
 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2
= 4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2
= 4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;
 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
11.(9分)如右图所示,水槽中试管内有一枚铁钉,放置数天后观察:


(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,电极反应:负极: ,正极: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com