
题目列表(包括答案和解析)
2.(1)正确;NH4Cl(AgNO3、NH4NO3);CH3COOH和CH3COONa(只答一种可能)(2)正确;CH3COONa;NH3·H2O和NH4Cl(3)不正确;因[H+]+[A+]>[B-]+[OH-]
1.(1)否,若a=3,则b=6,溶液显酸性,与意不符,故a≠3(2)否,若a=5,[H+]a=10-5mol·L-1则b=10,[OH-]b=10-4,mol·L-1V(a)/(b)=[OH-]b/[H+]a>1,不符合题意,a≠b(3)V(a)/(b)=10(a+b=14)<1,a+b-14<0,且a=0.5b故7/2<a14/3
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
B |
D |
D |
B |
B |
C |
C |
CD |
C |
AC |
D |
C |
B |
C |
A |
|
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
D |
D |
C |
B |
C |
D |
B |
B |
AD |
BD |
D |
D |
C |
B |
C |
7.某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度(选填大于、小于或等于)
25℃,其理由是
。
若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合液为中性,则a:b= : ;此溶液中各种离子的浓度由大到小排列顺序是 。
(2)若所得混合液的pH=2,则a:b= : ;此溶液中各种离子的浓度由大到小排列顺序是 。 参考答案
6.在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg CO2,为保持飞船内空气的成分稳定,宇航科学家进行了大量的科学探索,有的科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下
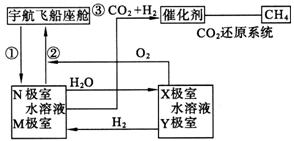
(1)管道①的作用是飞船座舱中含较多二氧化碳后潮湿空气通入“电化学二氧化碳”处理系统的N极室,该电极反应可以使二氧化碳不断被吸收,其反应方程式为: ,其电解产物吸收二氧化碳的离子方程式为 ,在N极吸收二氧化碳后形成的离子会通过隔膜进入M极室,通过M极的电极反应可以使二氧化碳从电解溶液中释放出来,并保持系统内pH不变,该电极反应式为 。二氧化碳逸出的离子方程式为 。
(2)管道②的作用是将处理后的空气混入“电解水系统产生的新鲜氧气”,然后通入飞船座舱内供宇航员呼吸用。在电解水系统中,Y为 (填阴极、阳极)。X极的电极反应式 。
 (3)逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”,在该系统内,二氧化碳跟氢气在一定条件下反应,其产物有甲烷等气体。请评价这样处理的重要意义。
(3)逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”,在该系统内,二氧化碳跟氢气在一定条件下反应,其产物有甲烷等气体。请评价这样处理的重要意义。
5.银器皿日久表面逐渐变黑,这是由于生成硫化银。有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐水放入一铝制容器中,再将变黑银器浸入溶液中,放置一段时间后,黑色褪去而银不会损失,试回答
(1)原电池的正极反应为: 负极反应为:
(2)在反应过程中有臭鸡蛋气味的气体产生,写出电池的总反应方程式 。
4. 25℃,pH=x的盐酸aL与pH=y的NaOH溶液bL恰好中和(x≤6、y≥8)。
25℃,pH=x的盐酸aL与pH=y的NaOH溶液bL恰好中和(x≤6、y≥8)。
(2)若x+y>14,则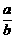 = ;(用x、y表示)且a= b(“>”“<”“=”)
= ;(用x、y表示)且a= b(“>”“<”“=”)
3.准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01mL |
18.60mL |
|
第二次 |
0.20mL |
18.00mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3测出的盐酸浓度 (填“偏高”、“偏低”或不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? 填 “是”或“否”)
2.已知某溶液中含有4种离子:A+、B一、H+、OH一,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B+组成物质的化学式(只写一种情况,可以是一种溶质,或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)[B- ]>[A+]>[H+]>[OH- ]:
(2)[A+]>[B- ]>[OH- ]>[H+]:
(3)[H+]>[B- ]>[A+]>[OH- ]:
1.25℃时,若体积为Va、pH=a的某一无强酸与体积为Vb、pH=b的某一元强碱恰好中和,且已知是Va<Vb和a=0.5b,请填写下列空白
(1)a值可否等于3(填“可”或“否”) ,其理由是 。
(2)a值可否等于5(填“可”或“否”) ,其理由是 。
(3)a的取值范围是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com