
题目列表(包括答案和解析)
22. (11分)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:

pH值控制可参考下列数据
|
物 质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4/ D c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的目的_____________________________________________。
(3)II中加Cu2(OH)2CO3的目的是___________________________________________;
其优点是____________________________________________________________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
(6)V到VI的操作是
(7)某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。
如何改进___________________。
21.(5分)某同学想通过比较两种最高价氧化物对应水化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了如图所示的装置。请回答:
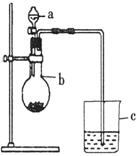 (1)仪器a的名称是 ,应盛放下列药品中的 。
(1)仪器a的名称是 ,应盛放下列药品中的 。
A.稀硫酸 B.亚硫酸 C.氢硫酸 D.盐酸
(2)仪器b的名称是 ,应盛放下列药品中的 。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)如果观察到C中的现象为 ,即可证明硫与碳的非金属性的强弱。
20、在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是 ( )
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在D点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+)
C.在C点:c(CH3COO-)>c(Na+)>
c(OH-)>c(H+) 
D.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
第II卷 (共50分)
19、三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”,饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性。有关说法符合题意的
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO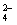 使人体中的蛋白质变性
使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为Cu2++ 2OH-=Cu(OH)2
A.①④ B.②④ C.③ D.均不正确
18.下列叙述正确的是
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
17. 25℃时,下列各溶液中有关物质的量浓度关系正确的是
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
c(Na+) >c(CH3COO-)>c(H+)>c(OH-)
B.常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:
c(Na+) > c(CH3COOH) >c(CH3COO-)>c(H+)>c(OH-)
C.向NH4HSO4溶液中滴加等物质的量的NaOH:
c(Na+) =c(SO42-) >c(NH4+) >c(H+) >c(OH-)
D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
c(CH3COONa)>c(Na2CO3) >c(C6H5ONa ) >c(NaOH )
16、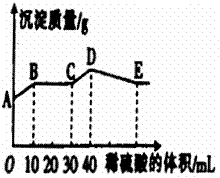 将由NaOH、
将由NaOH、 、
、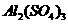 三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是( )
三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是( )
A、 AB段发生反应的的离子方程式为:
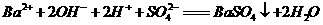
B、
BC段发生反应的离子方程式为: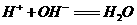
C、
D点表示的沉淀的化学式为 、
、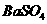
D、 E点表示的溶液呈中性
15.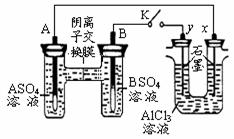 某同学按右图所示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是
某同学按右图所示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是
A.金属活动性A强于B
B.B 的电极反应: B-2e一= B2+
C.x电极上有 H2 产生,发生还原反应
D.反应初期, x 电极周围出现白色沉淀,不久沉淀溶解
14.根据下列短周期元素性质的数据判断,下列说法正确的是
 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/10-10 m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
A.元素①⑧形成的化合物具有两性 B.元素⑦位于第二周期Ⅴ族
C.元素④⑤形成的化合物是离子化合物 D.元素③的最高价氧化物对应水化物碱性最强
13.下列实验能达到预期目的的是
|
序号 |
实验操作 |
实验目的 |
|
A |
浓、稀HNO3分别与Cu反应 |
比较浓、稀HNO3的氧化性强弱 |
|
B |
金属钠投入硫酸铜溶液中 |
置换出铜 |
|
C |
把铜和银用导线连接后插入稀硫酸中 |
组成原电池验证铜比银活泼 |
|
D |
用等浓度的盐酸、碳酸氢钠两溶液混合反应 |
比较盐酸、碳酸的稳定性强弱 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com