
题目列表(包括答案和解析)
12.对下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝贮存,说明铝与浓硝酸不反应
D. CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水也不溶于稀硫酸
11、下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 ( )
①热纯碱溶液洗涤油渍的能力强;②误将钡盐[BaCl2、Ba(NO3)2等]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;③溶洞、珊瑚的形成;④碳酸钡 不 能做“钡餐”而硫酸钡则能; ⑤泡沫灭火器灭火的原理
A. ②③④ B. ①②③ C. ③④⑤ D. ①②③④⑤
10.一种常用的泡沫灭火器构造如下图。内筒a是玻璃瓶,外筒b是钢瓶,平时泡沫灭火器内筒外筒盛有液态试剂,当遇火警时,将灭火器取下倒置,内外筒液体试剂立即混合产生
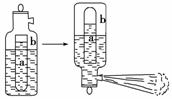 大量CO2泡沫灭火,从液态试剂在灭火器中长久放置和快速灭火两个角度分析,盛放药品正确的是( )
大量CO2泡沫灭火,从液态试剂在灭火器中长久放置和快速灭火两个角度分析,盛放药品正确的是( )
A.a中盛饱和Na2CO3溶液,b中盛Al2(SO4)3溶液
B.a中盛饱和NaHCO3溶液,b中盛Al2(SO4)3溶液
C.a中盛Al2(SO4)3溶液,b中盛饱和Na2CO3溶液
D.a中盛Al2(SO4)3溶液,b中盛饱和NaHCO3溶液
二,单项选择(共30分)
9.随着科学技术的不断进步,研究物质的手段和途径越来越多,许多分子及分子碎片如C60、N5+、H3、O4等已相继被发现。下列有关这些物质的说法中,正确的是( )
A.N5+离子中含有36个电子 B.C60的摩尔质量为720g
C.H2和H3属于同素异形体 D.O2和O4属于同位素
8.关于下列各装置图的叙述中,正确的是( )

A.若采用装置①精炼铜,则d为粗铜,c为精铜,电解质溶液为CuSO4溶液
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO等气体
C.装置③中X若为苯,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
7、著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融Ce02制Ce,铈在阳极获得
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(S04)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同位素
6. H2CO3和H2S在25℃时的电离常数如下:
|
电离常数 |
Ki1 |
Ki2[来源:] |
|
H2CO3[来源:ZXXK] |
4.2×10-7 |
5.6×10-11 |
|
H2S |
5.7×10-8 |
1.2×10-15 |
则下列反应可能发生的是 ( )
A. NaHCO3+NaHS=Na2CO3+H2S↑ B. H2S+Na2CO3=NaHS+NaHCO3
C. Na2S+H2O+CO2= Na2CO3+H2S↑ D. H2S+NaHCO3=NaHS+H2CO3
5.设NA为阿佛加德罗常数,下列叙述中正确的
A.标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA
B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA
C.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
4.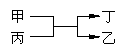 甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,
,
甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,
,
满足条件的甲和乙为 ( )
A.铝和铁 B.氯气和碘 C.碳和硅 D.镁和碳
3.在由水电离出的=1×10-12mol·L-1的溶液中,一定能大量共存的离子组是( )
A.NH4+、Ba2+、NO3-、Cl- B.Cl-、SO42-、Na+、K+
C.SO42-、NO3-、Fe2+、Mg2+ D.Na+、K+、ClO-、I-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com