
题目列表(包括答案和解析)
8. 实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是 ( )
A.240 mL 0.2 mol·L-1 的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器
B.向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体
C.不慎将NaOH溶液溅到皮肤上,应立即用较多的水冲洗
D.用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出
7.(2009年广州市二模)下列实验装置设计正确,且能达到目的的是 ( )
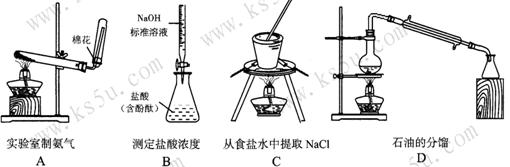
6.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A . 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C . 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
5.( 09年广东化学模拟)下列有关实验过程中,一般不需要使用玻璃棒进行操作的是( )
①用pH试纸测定Na2C03溶液的pH
②将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
③从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
④用已知浓度的盐酸和滴定未知浓度的氢氧化钠溶液
⑤用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑥探究Ba(OH)2·8H20晶体和NH4Cl晶体反应过程中的能量变化
⑦实验室用新制的FeS04溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
A.①③⑦ B.③④⑤ C.②④⑦ D.①③⑤⑥
4.(珠海市2009高三二模)实验室里不宜长期放置,应在使用时才配制的试剂是( )
①酚酞试液 ②银氨溶液 ③Na2CO3溶液 ④Cu(OH)2悬浊液
⑤酸性FeCl3溶液 ⑥FeSO4溶液 ⑦NaCl溶液 ⑧氯水
A.②⑤⑥⑧ B.①③④⑤ C.①②⑤⑦ D.②④⑥⑧
3. 下列实验装置设计或操作肯定错误的是
( )
下列实验装置设计或操作肯定错误的是
( )
2.(惠州市2009届二模)下列各装置中,夹紧②、③、④中的弹簧夹,并作相关操作,会漏气的装置是 ( )
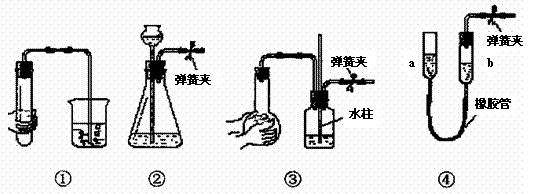 A.对装置①,双手移去后.导管中水面与烧杯水面相平
A.对装置①,双手移去后.导管中水面与烧杯水面相平
B.对装置②,长颈漏斗内液面高度保持不变
C.对装置③,长导管内形成一段水柱
D.对装置④,上移a管后,a、b两端液面形成了一段稳定的高度差
1.下列结论均出自《实验化学》中的实验,其中错误的是 ( )
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘。
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据。
C.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干。
D.提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量。
10.某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应或氢氧化钠反应):
①配制0.100 mol·L-1稀盐酸和0.100mol·L-1NaOH溶液
②取一粒药片(0.100g)研碎后加入20.0ml蒸馏水
③用0.100 mol·L-1NaOH溶液中和,用去体积为Vml
④加入25.0 mL 0.100 mol·L-1稀盐酸。请回答下列问题:
(1)测定过程的正确操作顺序为 (填序号)。
(2)测定过程中发生反应的离子方程式
(3)若某次实验需重复测定四次。实验室现有50ml、100ml、250ml、500ml四种规格的容量瓶,则配制盐酸应选用的容量瓶规格最好为 ,理由是
(4)某同学四次测定的V数据如下:
|
测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
Vml |
15.4 |
12.9 |
13.1 |
13.O |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数。
 11.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
11.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含 mgFeSO4·7H2O为片剂。
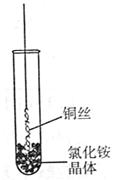 8.(山东省2009届高三检测)Ⅰ.将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑。再在酒精灯上将该铜丝加热至红热状态。
8.(山东省2009届高三检测)Ⅰ.将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑。再在酒精灯上将该铜丝加热至红热状态。
如右图所示,趁热插入到试管里的氯化铵晶体中,在试管中
出现白烟。冷却后取出铜丝,可看到铜丝变成光亮的紫红色。
回答下列问题:
(1)解释“当红热的铜丝插入氯化铵晶体中,出现白烟”的原因。
(用化学方程式表示) 。
(2)灼热的氧化铜在氯化铵中变成单质铜,写出该反应的化学
方程式 。
II.2008年,我国的航天事业取得了巨大的成就,航天员翟志刚
顺利实现了太空行走。在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
(1)N2H4·H2O能发生类似NH3·H2O的微弱电离,使溶液显示弱碱性,该电离分两步,写出第一步电离的方程式 。
(2)在实验室中,用水合肼(N2H4·H2O)与NaOH颗粒一起蒸馏,收集114-116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
A.酒精灯 B.长直玻璃导管 C.锥形瓶 D.冷凝管
E.牛角管(接液管) F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是
(3)肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,每生成1molFe3O4,转移电子的物质的量为 ,需要消耗肼的质量为
9.( 2009年浙江高考15分)单晶硅是信息产业中重要的基础材料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃)四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
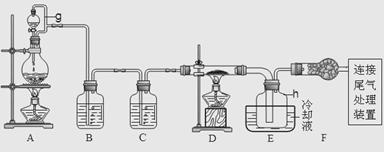
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+5===5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?_________(填 “是”或“否”),请说明理由__________。
②某同学称取5.000g残留物后,所处理后在容量中瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com