
题目列表(包括答案和解析)
18.下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素
 ⑴下列__________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力;②形成稳定结构的倾向。
下表是一些气态原子失去核外不同电子所需的能量(kJ?mol-1):
⑴下列__________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力;②形成稳定结构的倾向。
下表是一些气态原子失去核外不同电子所需的能量(kJ?mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量__________________________________。 ②表中X可能为以上13种元素的_______________(填写字母)元素。用元素符号表示X和j形成化合物的化学式_____________________________________________。 ③Y是周期表中________________________________族元素。 ④以上13种元素中,__________________________(填写字母)元素原子失去核外第一个电子需要的能量最多。
14.若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、第四、第五周期含有的元素分别有
A.5种、10种、15种 B.8种、18种、18种
C.8种、10种、15种 D.9种、10种、15种 二.填空题
15.铁元素核外有26个电子
⑴铁元素位于元素周期表中第___________周期,第___________族。
⑵Fe3+的电子排布式___________。
⑶Fe2+的外围电子轨道表示式___________。
⑷为什么Fe3+在自然界Fe的各种存在形式中最为常见?___________。
⑸目前发现的铁的最高化合价是+6价,理论上最高价是___________。 16.钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。钛有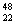 Ti和
Ti和 Ti两种原子,它们互称为___________。Ti元素在元素周期表中的位置是第___________ 周期,第___________ 族;基态原子的电子排布式为___________;按电子排布Ti元素在元素周期表分区中属于___________ 区元素。 17.A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有3个电子。
⑴C原子的电子排布式为_______,若A元素的原子最外层电子排布为1s1,则A与C按个数比1:1形成的化合物的电子式__________。
⑵当n=2时,B的原子结构示意图为________,B与C形成的化合物的结构式为___________。
⑶若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是__________,A、B、C、D四种元素的第一电离能由大到小的顺序是 _____________________(用元素符号表示)。
Ti两种原子,它们互称为___________。Ti元素在元素周期表中的位置是第___________ 周期,第___________ 族;基态原子的电子排布式为___________;按电子排布Ti元素在元素周期表分区中属于___________ 区元素。 17.A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有3个电子。
⑴C原子的电子排布式为_______,若A元素的原子最外层电子排布为1s1,则A与C按个数比1:1形成的化合物的电子式__________。
⑵当n=2时,B的原子结构示意图为________,B与C形成的化合物的结构式为___________。
⑶若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是__________,A、B、C、D四种元素的第一电离能由大到小的顺序是 _____________________(用元素符号表示)。
13.下列叙述中正确的是( ) A.同周期元素中,ⅦA族元素的原子半径原子大 B.ⅥA族元素的原子,其半径越大,越容易得到电子 C.室温时,零族元素的单质都是气体 D.同一周期中,碱金属元素的第一电离能最大
12.某主族元素X的原子有一个未成对电子,其原子序数小于18,大于10,下列有关元素X的叙述正确的是( ) A.一定是活泼金属元素 B.一定是活泼非金属元素 C.X的氧化物有两性 D.X一定能形成离子化合物
11.处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列关于A、B、C、D四种元素的说法中,正确的是( ) ①元素的非金属性依次增强;②元素的电负性依次减小;③元素的第一电离能依次增大;④最高价氧化物对应水化物的酸性依次减弱。 A.①④ B.②④ C.①③ D.③④
1.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wuithrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N的叙述正确的是(
A.13C与15N有相同的中子数
B.13C电子排布式为1s22s22p3
C.15N与14N互为同位素
D.15N的电子排布式为1s22s22p4
2.下列关于1S电子在原子核外出现的概率分布图,也称电子云示意图 (如右图所示)的有关说法中,正确的是
A.通常用小黑点来表示电子的多少,
B.小黑点密度大,说明在该核外空间电子数目多
C.通常用小黑点来表示电子绕核作高速圆周运动
D.小黑点密,表示在该核外空间的单位体积内电子出现的机会大
3.寻找优良的半导体材料,应在周期表的哪个位置寻找
A.s区 B.p区 C.d 区 D.ds区
4.下列化学用语,不能表示氯离子的是
A.Cl- B.
(如右图所示)的有关说法中,正确的是
A.通常用小黑点来表示电子的多少,
B.小黑点密度大,说明在该核外空间电子数目多
C.通常用小黑点来表示电子绕核作高速圆周运动
D.小黑点密,表示在该核外空间的单位体积内电子出现的机会大
3.寻找优良的半导体材料,应在周期表的哪个位置寻找
A.s区 B.p区 C.d 区 D.ds区
4.下列化学用语,不能表示氯离子的是
A.Cl- B. C.
C. D.1s22s22p63s23p6
5.下列表达方式错误的是( )
A.甲烷的电子式
D.1s22s22p63s23p6
5.下列表达方式错误的是( )
A.甲烷的电子式 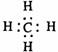 B.氟化钠的电子式
B.氟化钠的电子式  C.硫离子的核外电子排布式 1s22s22p63s23p4
D.碳-12原子
C.硫离子的核外电子排布式 1s22s22p63s23p4
D.碳-12原子  C
6.某离子X2+的最外层电子排布是5s2。当把固体XCl2溶于水配制成溶液时,需加入少量的单质X和盐酸。由此判断下列说法正确的是( )
A.X元素常见的化合价是+2和+4价 B.X(OH)2是强碱
C.XCl2溶液显酸性 D.X元素的最高价氧化物的水化物显强酸性
7.下列元素一定是主族元素的是( )
A.原子核外N电子层上只有一个电子的元素
B.原子核外M层电子数为偶数的元素
C.原子核外M层电子数为奇数的元素
D.原子核外N层电子数为2的元素
8.电子排布式为1s22s22p4的元素易与具有下列电子排布式的元素形成离子化合物的是(
)
A.1s22s22p6
B.1s2
C.1s22s22p5 D.1s22s22p63s2
9.下列四种元素中,其单质氧化性最强的是(
)
A.原子含有未成对电子最多的第2周期元素
B.位于周期表中第3周期第ⅢA族的元素
C.原子最外层电子排布式为2s22p6的元素
D.原子最外层电子排布式为3s23p6的元素
10.下列说法中正确的是( )
A.d区元素外层电子排布式为ns1~2
B.电负性越大的元素的原子越容易获得电子
C.第一电离能越小的元素的原子越容易获得电子
D.若BeCl2是共价化合物,则可推知BeF2应为离子化合物
C
6.某离子X2+的最外层电子排布是5s2。当把固体XCl2溶于水配制成溶液时,需加入少量的单质X和盐酸。由此判断下列说法正确的是( )
A.X元素常见的化合价是+2和+4价 B.X(OH)2是强碱
C.XCl2溶液显酸性 D.X元素的最高价氧化物的水化物显强酸性
7.下列元素一定是主族元素的是( )
A.原子核外N电子层上只有一个电子的元素
B.原子核外M层电子数为偶数的元素
C.原子核外M层电子数为奇数的元素
D.原子核外N层电子数为2的元素
8.电子排布式为1s22s22p4的元素易与具有下列电子排布式的元素形成离子化合物的是(
)
A.1s22s22p6
B.1s2
C.1s22s22p5 D.1s22s22p63s2
9.下列四种元素中,其单质氧化性最强的是(
)
A.原子含有未成对电子最多的第2周期元素
B.位于周期表中第3周期第ⅢA族的元素
C.原子最外层电子排布式为2s22p6的元素
D.原子最外层电子排布式为3s23p6的元素
10.下列说法中正确的是( )
A.d区元素外层电子排布式为ns1~2
B.电负性越大的元素的原子越容易获得电子
C.第一电离能越小的元素的原子越容易获得电子
D.若BeCl2是共价化合物,则可推知BeF2应为离子化合物
20.某元素的同位素AZX,它的氯化物XCl2 1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,求:k.s.5.u
(1)Z值和A值。
(2)X元素在周期表中的位置。
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
19.金属钨晶体为体心立方晶格,如图所示,实验测得 钨的密度为19.30 g·cm-3,原子的相对质量为183,假定金属钨原子为等径的刚性球。
钨的密度为19.30 g·cm-3,原子的相对质量为183,假定金属钨原子为等径的刚性球。
(1)试计算晶胞的边长;(2)试计算钨原子的半径。k.s.5.u
18.用X射线研究某金属晶体,测得在边长为360pm的立方晶胞中含有4个金属原子,此时金属的密度为9.0g/cm3。试回答:
(1)此金属晶格属于哪一种晶格类型?
(2)每个晶胞的质量是多少克? k.s.5.u
k.s.5.u
(3)求此金属的相对原子质量。
(4)求此原子的原子半径(pm)。
17.9.6g元素A与4.2g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%。推算出A、B在周期表中的位置。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com