
题目列表(包括答案和解析)
24.(11分)
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超AK6NH4AlO(OH)HCO3细热分解的化学反应方程式----------------。
(2)NH4Al(SO4)2 的相对分子质量为453。欲配制100mlPH为2浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
的相对分子质量为453。欲配制100mlPH为2浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2 12H2O固体-------------g
12H2O固体-------------g
②将上述固体置于烧杯中------------------------
(3)在0.1mol l-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液ph变化的关系见下图
l-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液ph变化的关系见下图
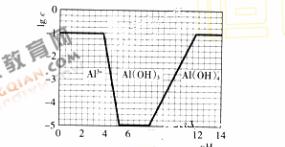
①用NaOH溶液调节(2)中溶液ph至7,该过程中发生反应的离子方程式有---------------②请在答题卡的框图中,画出0.01mol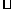 l-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液ph变化的关系图,并进行必要的标注。
l-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液ph变化的关系图,并进行必要的标注。
23、(11分)
磷单质及其化合物的、有广泛应用。
(1) 同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) 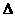 H
H
①上述反应中,副产物矿渣可用来 。
②已知相同条件下:
4Ca3(PO4)2(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSio3(s)+SiF4(g)
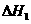
2Ca3s(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
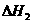
SiO2(s)+CaO(s)=CaSiO3(s)
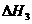
用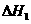 、
、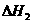 和
和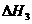 表示
表示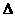 H
H ,
,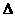 H
H =
=
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
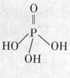
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 。
②化学镀镍的溶液中含有和,在酸性等条件下发生下述反应:
(a) N12+ + H2PO-2 + → Ni+ H2PO-3 +
(b)6H2PO-2
+2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;原理上的不同点: ;化学镀的优点: 。
22.(12分)
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2\、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
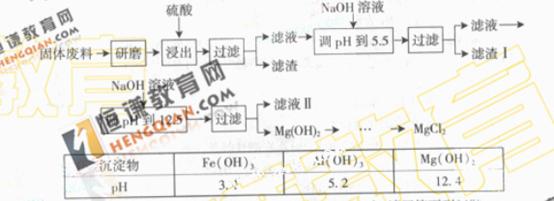
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)
(2)滤渣I的主要成分有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
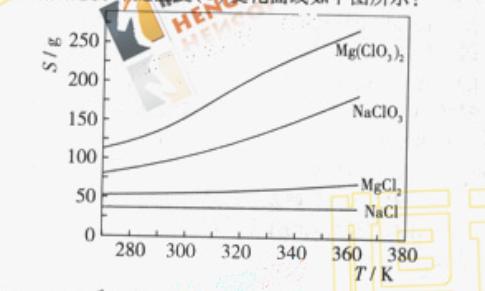
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
21.(12分)
三草酸合铁酸钾晶体K3 [Fe(C3O4 )3]·3H2O可有于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1HNO、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2 、0.1mol·L-1KI、0.1 mol·L-1CuSO4、20% KSCN、澄清石灰水,氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C)观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1: ; 假设2: ;假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。

20.(10分)
甲酸甲酯水解反应方程式为:
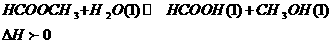
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:

甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1) 根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:

请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为: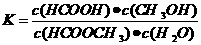 ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
19.(12分)
某试验小组利用如下装置(部分固定装置略)制备氧化钙(Ca3N2),并探究其实验式。
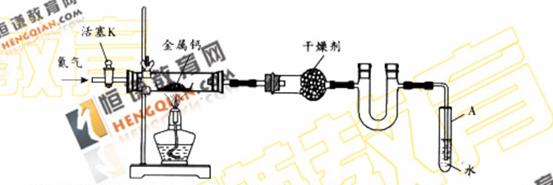
(1)按图连接好实验装置。检查装置的气密性,方法是 。
(2)反映过程中末端导管必须插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:

①计算得到实验式Ca2N2,其中x= .
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据: 。
18.硫酸锶(SrSO4)在水中的深沉溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随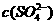 的增大而减小
的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到263K后变为不饱和溶液

17、 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2+H+下列说法正确的是
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
16、磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
A.-H3PW12O40在该酯化反应中其催化作用
 B. 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
B. 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
D.硅钨酸H4 SiW12O40也是一种杂多酸,其中W的化合价为+8
15、取5等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g) N2O4(g),
N2O4(g),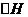 <0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com