
题目列表(包括答案和解析)
9.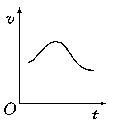 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
(1)反应开始进行时,反应速率加快的原因是
;
(2)反应后期,反应速率下降的原因是
。
(此题考查学生接受信息的能力、分析和解决问题的能力。答题时要挖掘引起H+浓度增大的原因。)
8.在25℃时,向100mL含HCl14.6g的盐酸溶液中,放入5.6g纯铁粉(若不考虑反应前后溶液体积的变化),反应进行至2min末收集到1.12L(标况)氢气,在此之后又经过4min,铁粉完全溶解。则:
(1)前2min内用氯化亚铁表示的平均反应速率是 (2)后4min内用HCl表示的平均反应速率是
(3)前2min与后4min相比,反应速率较快的是 ,其原因是
。
(本题考查学生对化学反应速率的理解,对化学反应速率表示方法的认识,以及运用化学方程式中各物质的化学计量比的关系进行有关简单计算。答题时要审清题意,注意是用何种物质来表示反应速率的。)
7.增加反应物的浓度、增大压强(有气体参加的反应)、升高温度和使用催化剂都可以增大反应速率。其中能增大反应物分子中活化分子百分数的是 ,
理由是
。
(增大化学反应速率的因素较多,该题要求学生从本质上作出合理的解释。答题时主要考虑活化能的大小对反应速率的影响。)
6.在恒温、恒容的密闭容器中反应A(g) B(g)+C(g);△H<0。若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需时间为( )
B(g)+C(g);△H<0。若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需时间为( )
A.10s B.大于10s C.小于10s D.无法判断
(该题考查浓度对化学反应速率的影响。答题时依据反应速率的定义计算式及反应速率逐渐减慢的特征进行思考.)
4.NO和CO都是汽车排放尾气中的有害物质,它们能缓慢的反应,生成氮气和二氧化碳,对此反应下列叙说正确的是( )
A.使用催化剂并不能改变反应速率
B.使用催化剂可以改变反应速率
C.降低压强能加快反应速率
D.升高温度可以加快反应速率
(此题以汽车排放的有害尾气为背景,考查学生对影响化学反应速率因素的认识,及灵活运用理论知识解决实际问题的能力。答题时根据影响化学反应速率的因素及其规律作出判断。)
3.
 设C+CO2 2CO;△H>0,反应速率为v1,N2+3H2 2NH3;△H<0
反应速率为v2,对于上述反应,当温度
设C+CO2 2CO;△H>0,反应速率为v1,N2+3H2 2NH3;△H<0
反应速率为v2,对于上述反应,当温度
升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
(本题考查学生对化学反应速率受温度影响的掌握情况。答题时注意区分温度对化学反应速率的影响与对化学平衡影响。)
2.下列措施肯定能使化学反应速率增大的是( )
A.增大反应物的量 B.增大压强
C.升高温度 D.使用正催化剂
(此题以影响化学反应速率的因素为依托,考查学生深刻而全面分析问题的能力。答题时根据影响化学反应速率的因素及其适用范围作出判断。)
1.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应的快慢
 D.对于任何化学反应来说,反应速率越大,反应现象越明显
D.对于任何化学反应来说,反应速率越大,反应现象越明显
(该题考查学生对化学反应速率概念的理解情况。答题时意义要明确、表示方法要清楚。)
4.(2000年高考科研试测题)下表所列数据是在某高温下金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚Y/nm |
0.05a |
0.20a |
0.45a |
0.80a |
1.25a |
|
NiO层厚Y’/nm |
b |
2b |
3b |
4b |
5b |
注:a和b均为与温度有关的常数
请填空回答:
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是
。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是(填“直线”或“抛物线”,“对数”或“双曲线”等类型):MgO氧化膜膜厚Y属 型,NiO氧化膜膜厚Y’属
型。
(3)Mg与Ni相比较,金属 具有更良好的耐高温氧化腐蚀性,其理由是
。
(该题考查学生获取、分析和处理图表信息的能力及应用数学工具解决化学问题的能力,体现了学生的综合素质。答题时要综合运用化学和数学的某些基本知识,从实验数据出发,建立数学模型(定量规律),进而从物质内部结构作出解释,这是化学研究问题常用的一种方法。)
新活题网站
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com