
题目列表(包括答案和解析)
1.0n=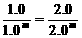 则m=1
则m=1
选择c(H2)=2.0 mol/L的两种情况:
1.C 2.CD 3.A 4.BD 5.D 6.B
讲析:2.若反应物为固体或纯液体,增大其量对反应速率无影响。压强只是对有气体参加或生成的反应而言,改变压强会改变速率。3.温度升高,反应速率都增大。对于一个可逆反应来说,吸热反应速率增大的倍数比放热反应增大的倍数要大。5. 选择c(Cl2)=1.0 mol/L的两种情况:
4.(1)反应速率可用反应物的消耗速率,也可用产物的生成速率来表示。(2)直线、抛物线。(3)Ni,它的腐蚀速率随时间的增长比镁的要慢。
讲析:4.(1)金属因高温氧化反应,遭到破坏是常见的一种腐蚀现象。然而,不同的金属因其所形成的氧化膜致密程度不同,它们的耐腐蚀性亦不同。化学反应的快慢既可由反应物消耗速率表示,也可由生成物的生成速率来表示,显然,金属的腐蚀速率可用其氧化膜的生长速率表示。(2)根据题给数据不难导出以下数学关系式:MgO膜厚Y与时间t的关系为:Y=0.05at;NiO膜厚Y’与时间t的关系为Y’=bt1/2。由数学知识知,前者为直线型,后者为抛物线型。(3)据此可知Y’随时间t增长要比Y随时间t增长得慢,故而镍的耐高温氧化腐蚀性要比镁的好。
新活题网站
2. 影响化学反应速率的因素有温度、浓度、压强、催化剂,还有增大固体反应物的有效表面积等。从稀硫酸改用98%浓硫酸,虽然浓度增大了,但浓硫酸使铁钝化而不能产生氢气。滴加少量硫酸铜溶液,铁与其发生置换反应,形成Cu-Fe原电池,使反应速率加快。 3.从曲线变化的趋势看,在反应过程中物质N逐渐减少,物质M逐渐增多。当时间为0时, 容器中M和N两物质的物质的量均不为0,且分别为2mol和8mol;t1时,N物质由8mol减至6mol,减少量为2mol,M物质由2mol增至3mol,增加量为1mol,说明M,N之间的量变关系为:M
影响化学反应速率的因素有温度、浓度、压强、催化剂,还有增大固体反应物的有效表面积等。从稀硫酸改用98%浓硫酸,虽然浓度增大了,但浓硫酸使铁钝化而不能产生氢气。滴加少量硫酸铜溶液,铁与其发生置换反应,形成Cu-Fe原电池,使反应速率加快。 3.从曲线变化的趋势看,在反应过程中物质N逐渐减少,物质M逐渐增多。当时间为0时, 容器中M和N两物质的物质的量均不为0,且分别为2mol和8mol;t1时,N物质由8mol减至6mol,减少量为2mol,M物质由2mol增至3mol,增加量为1mol,说明M,N之间的量变关系为:M 2N或2N
2N或2N M。t1时容器中有M物质3mol,N物质6mol,即N的浓度是M浓度的2倍:t2时,M、 N两物质的物质的量相等,且为4mol,但不是正、逆反应速率相等;t3时,M、N的物质的量不随时间的变化而改变,是化学平衡状态的特征,说明正、逆反应速率相等。综上分析,答案为D。
M。t1时容器中有M物质3mol,N物质6mol,即N的浓度是M浓度的2倍:t2时,M、 N两物质的物质的量相等,且为4mol,但不是正、逆反应速率相等;t3时,M、N的物质的量不随时间的变化而改变,是化学平衡状态的特征,说明正、逆反应速率相等。综上分析,答案为D。
1.BD 2.B 3.D
 讲析:1.因A是固态物质,一般不用浓度变化表示反应速率,A不正确。v= 求的是平均反应速率。C不正确。
讲析:1.因A是固态物质,一般不用浓度变化表示反应速率,A不正确。v= 求的是平均反应速率。C不正确。
15.丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2 → CH3COCH2I +H+ +I-。 25℃ 时,该反应的速率由下列经验式决定:v=2.73×10-5c(CH3COCH3)c(H+) mol/(L•s)。
25℃时,如果c(I2)、c(CH3COCH3)、c(H+)的起始浓度依次是0.01mol/L、0.1mol/L、0.01mol/L,求:
(1)反应开始时的速率是多少?
(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
第11课时 (A卷)
典型题点击
14. Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ 2Fe2++I2(水溶液)
Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ 2Fe2++I2(水溶液)
(1)该反应的平衡常数K的表达式为:K=
当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡 移动(选填:向右、向左、不)。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:υ=κ{c(I-)}m{c(Fe3+)}n(κ为常数)
|
|
c(I-)(mol/L) |
c(Fe3+) (mol/L) |
(mol/L·s) |
|
(1) |
0.20 |
0.80 |
 0.032κ 0.032κ |
|
(2) |
0.60 |
0.40 |
0.144κ |
|
(3) |
0.80 |
0.20 |
0.128κ |
通过所给的数据计算得知:在υ=κ{c(I-)}m{c(Fe3+)}n中。m、n的值为 [选填(A)、(B)、(C)、(D)]
(A)m=1,n=1 (B)m=1,n=2
(C)m=2,n=1 (D)m=2,n=2
I-浓度对反应速率的影响 Fe3+浓度对反应速度的影响。(选填:小于、大于、等于)
13.在2L容器中,放入0.4molA和0.6molB,在一定温度下,压强为P,放入催化剂(体积忽略)发生反应:2A(g)+3B(g) x C(g)+2D(g),在amin后,容器中c(A)=0.1mol∕L。
x C(g)+2D(g),在amin后,容器中c(A)=0.1mol∕L。
(1)若温度与压强均未改变,求v(B)和x的值;
(2)若温度不变,压强变为9/10P,求v(C)和x 的值。
12.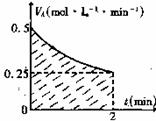 某溶液中发生反应:A
某溶液中发生反应:A 2B+C,VA-t 的关系如图。已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
2B+C,VA-t 的关系如图。已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
(1)图中阴影部分的面积表示2min内 的减小值,应小于 ;
(2)2min时,B的物质的量浓度的取值范围是 。
11.A、B两种气体物质在容器中进行反应,A+3B 2C,10℃时反应速率vB为0.3 mol·(L·s)-1,50℃时反应速率vA=25.6 mol·(L·s)-1,每升高10℃,该反应速率增至原来的
倍。
2C,10℃时反应速率vB为0.3 mol·(L·s)-1,50℃时反应速率vA=25.6 mol·(L·s)-1,每升高10℃,该反应速率增至原来的
倍。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com