
题目列表(包括答案和解析)
7.某化学反应2A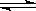 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
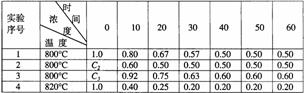
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<=),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”、“放热”)。理由是
。
(此题是有关化学反应速率、化学平衡的图表分析,意在考查学生对表中所隐含信息的观察能力。答题时利用温度不变时平衡常数不变及勒夏特列原理分析判断。)
第12课时 化学平衡(B卷)
易错现象
6.将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(s)+Dd
cC(s)+Dd
当反应进行一定时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡:
(1)该化学方程式中各物质的化学计量数为:a= 、b= 、c= 、d= ;
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A 、B 、D ;
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为 反应(填“放热”或“吸热”)。
(该题测试学生对化学反应规律、化学平衡的理解。解题时利用反应物和生成物之间所体现的计量关系并结合平衡移动原理来作答。)
5.A、B、C、D为四种可溶于水的物质,在稀溶液中建立如下平衡:A+2B+H2O C+D。当加水稀释时,平衡向 方向移动,理由是
C+D。当加水稀释时,平衡向 方向移动,理由是
。
(本题考查学生对化学平衡移动原理的运用。答题时利用勒夏特列原理,注意语言的组织表达要恰当。)
4.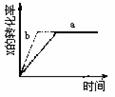 图中a曲线表示一定条件下可逆反应X(g)+Y(g)
图中a曲线表示一定条件下可逆反应X(g)+Y(g) 2Z(g)+W(s);ΔH<0的反应过程。若使a曲线变为b曲线,可采取的措施是( )
2Z(g)+W(s);ΔH<0的反应过程。若使a曲线变为b曲线,可采取的措施是( )
A.加入催化剂 B.增大Y的浓度
C.降低温度 D.增大体系压强
(本题借助于图象考查学生对化学反应速率及平衡的理解、外界条件对化学平衡的影响等知识。答题时要分析反应特点,剖析图示所体现的关系,然后作出合理的判断。)
3.在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2  N2O4;△H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色②平均摩尔质量③质量④压强⑤密度中不变的是( )
N2O4;△H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色②平均摩尔质量③质量④压强⑤密度中不变的是( )
A.③⑤ B.③④ C.②④ D.①③
(本题考查温度对化学平衡移动影响的有关知识。答题时注意烧瓶容积不变,并运用勒夏特列原理可解之。)
2.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) 2C(g)达到平衡,测得平衡时A、B、C物质的量之比n(A):n(B):n(C)=2:2:1。若保持温度不变,以2:2:1的物质的量之比再充入A、B和C,下列判断正确的是( )
2C(g)达到平衡,测得平衡时A、B、C物质的量之比n(A):n(B):n(C)=2:2:1。若保持温度不变,以2:2:1的物质的量之比再充入A、B和C,下列判断正确的是( )
A.平衡向正反应方向移动 B.平衡不会发生移动
C.C的质量分数增大 D.C的质量分数可能减小
(此题考查外界条件对平衡移动的影响问题,以及思维变通能力。答题时要注意题干的限制条件,通过等效假设解决问题。)
1.反应2A(g) 2B(g)+E(g);ΔH>0。达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+E(g);ΔH>0。达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压 B.减压 C.减小E的浓度 D.降温
(该题涉及外界条件对化学反应速率、化学平衡的影响两方面的内容,考查学生的辨别能力。答题时注意区分,防止混淆。)
4.(2003年全国高考题)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(g)+B(g)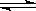 C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x=
mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是
。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b
(丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
(此题考查学生关于化学平衡的基础知识,以及分析、推理、组合、计算、评价等逻辑思维能力。答题时考虑化学平衡状态的建立与途径无关,运用假设建立可比较的参照依据,同时注意等效平衡规律的适用范围。)
新活题网站
3.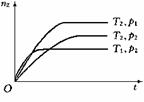 反应2X(g)+Y(g)
反应2X(g)+Y(g)  2Z(g);ΔH<0。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图
2Z(g);ΔH<0。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图
所示。下列推断正确的是( )
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
(本题考查学生对化学反应速率及平衡的理解、外界条件对化学平衡移动的影响等知识,以及识图能力。答题时要分析反应特点,抓住曲线“先拐后平”的特点加以分析。)
2.(2000年全国高考题)在一密闭容器中, 反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减少了 C.物质B的质量分数增加了
D.a>b
(该题主要考查学生对化学平衡基本概念的理解程度。答题时抓住“容器体积增加一倍”,此刻A、B的浓度均减半这一关键。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com