
题目列表(包括答案和解析)
3. 下列叙述中完全正确的一组是
下列叙述中完全正确的一组是
①常温常压下,1 mol甲基(-CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④常温常压下,16 g O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑦标准状况下,22.4 L水中含分子数为NA
A.①②③④⑤ B.②④⑤⑥⑦ C.②④⑤ D.①②⑤
2.类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.苯不能使酸性高锰酸钾溶液褪色,故苯的同系物也能使酸性高锰酸钾溶液褪色
D.CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO
1.21世纪被认为是“海洋世纪”,是人类大步走向海洋,开发利用海洋的世纪。下列有关海水资源的开发利用说法正确的是
A.在研究和开发海洋资源时,必要时可以以牺牲环境为代价
B.海水中含有溴元素,可以直接萃取得到溴单质
C.海水中的铀含量极低,从海水中提铀是十分不经济的行为
D.从海水中可提取Mg,用惰性电极电解熔融的MgCl2或其水溶液都可制得Cl2
21.(12分)
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1 :2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);
(3)C分子中都包含_______个σ键,_______个π键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
______________________________________________________。
Ⅱ.CO的结构可表示为C≡O,N2的结构可表示为N≡N。
(5)下表是两者的键能数据:(单位:kJ/mol)
|
|
A-B |
A=B |
A≡B |
|
CO |
357.7 |
798.9 |
1071.9 |
|
N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:______________________________________________
__________________________________________________________。
 Ⅲ.(6)基态Ni原子的核外电子排布式为 __
____ 。
Ⅲ.(6)基态Ni原子的核外电子排布式为 __
____ 。
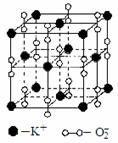
IV.(7)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
A.超氧化钾的化学式为KO2,每晶胞含有14个K+和13个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为3:1
20. (12分)某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究。请完成下列探究报告。
(12分)某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究。请完成下列探究报告。
 [探究目的]探究该焰火原料的组成
[探究目的]探究该焰火原料的组成
 [资料检索]
[资料检索]
①  Mg2+检验的方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入2滴镁试剂(I)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有Mg2+。注:Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+的检测
Mg2+检验的方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入2滴镁试剂(I)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有Mg2+。注:Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+的检测
②  Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液
Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液
③  很多合金是金属互化物,有确定的化学组成。
很多合金是金属互化物,有确定的化学组成。
 [探究思路]①确定该焰火原料所含金属种类;②测定该火焰原料的化学式
[探究思路]①确定该焰火原料所含金属种类;②测定该火焰原料的化学式
 [实验探究](1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
[实验探究](1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。

|
试验序号 |
实验步骤 |
实验现象 |
结论 |
|
① |
取少量该焰火原料, 加入冷水 |
无明显现象 |
|
|
② |
取少量该焰火原料, 加入稀盐酸 |
完全溶解,有大量气体 产生、溶液呈无色 |
|
(2)乙同学取甲同学第②组实验的溶液,加入镁试剂(I)染料,未见天蓝色物质。他得出合金中不含镁离子的结论。乙同学的结论 ,(选填“正确”或“错误”)你的理由是 。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下
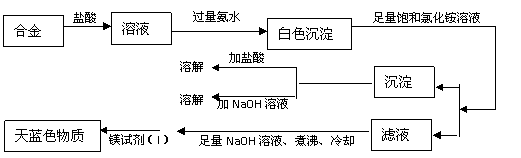
由丙同学的实验记录可知该焰火原料是由 和 两种金属组成的合金;
实验中滤液加入足量氢氧化钠溶液后需煮沸的理由是 。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。

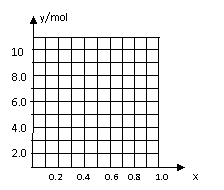 问题讨论:
问题讨论:
①能确定合金组成的数据组有 (填写选项字母)。
A.m、n B. m、y C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,
金属总物质的量为7mol,试在右图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为
。
19. (10分)带支链的烷烃A(C6H14)只可能有三种一氯取代产物B、C和D,以上反应及B的进一步反应如下图所示。
(10分)带支链的烷烃A(C6H14)只可能有三种一氯取代产物B、C和D,以上反应及B的进一步反应如下图所示。


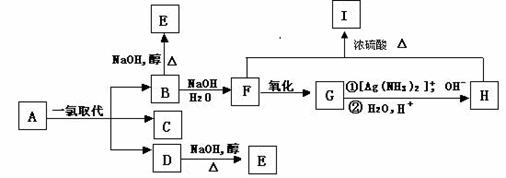







 请回答:
请回答:
 (1)A的名称是
,I的分子式是 。
(1)A的名称是
,I的分子式是 。
 (2)写出下列反应的化学方程式:
(2)写出下列反应的化学方程式:
 B→F______________________________________________________________;
B→F______________________________________________________________;
 D→E______________________________________________________________。
D→E______________________________________________________________。
 (3)将1molA的一氯取代物的混合气体充分燃烧,生成CO2、H2O和HCl,则需氧气 ________________mol。
(3)将1molA的一氯取代物的混合气体充分燃烧,生成CO2、H2O和HCl,则需氧气 ________________mol。
 (4)某一有机物X是H的同分异构体,可发生下列变化:
(4)某一有机物X是H的同分异构体,可发生下列变化:

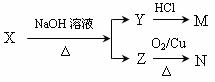
 已知M为羧酸,且M、N均不发生银镜反应,则X的可能结构有_____________种;写出Z可能的结构简式:_____________________________________________
已知M为羧酸,且M、N均不发生银镜反应,则X的可能结构有_____________种;写出Z可能的结构简式:_____________________________________________
18.
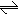 (8分)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
(8分)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:





 ①计算20s-40s内用N2O4表示的平均反应速率为
mol/L.
①计算20s-40s内用N2O4表示的平均反应速率为
mol/L.
 ②计算在80℃时该反应的平衡常数K=
;
②计算在80℃时该反应的平衡常数K=
;
 ③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)
;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)
;
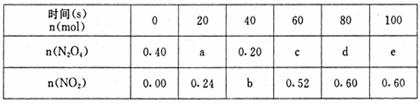
 ④要增大该反应的K值,可采取的措施有(填序号)
④要增大该反应的K值,可采取的措施有(填序号)

 A.增大N2O4的起始浓度
A.增大N2O4的起始浓度
 B.向混合气体中通入NO2
B.向混合气体中通入NO2
 C.使用高效催化剂
C.使用高效催化剂
 D.升高温度
D.升高温度
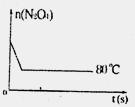
 ⑤如图是80℃时容器中N2O4物质的量的变化
⑤如图是80℃时容器中N2O4物质的量的变化
 曲线,请在该图中补画出该反应在60℃时
曲线,请在该图中补画出该反应在60℃时
 N2O4物质的量的变化曲线。
N2O4物质的量的变化曲线。
 (2)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
(2)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
 NO3-+4H++3e→NO+2H2O
NO3-+4H++3e→NO+2H2O
 从KMnO4、Na2CO3、Cu2O、Fe2(SO4)3这四种物质中选出一种物质(甲),甲物质能使上述还原过程发生。
从KMnO4、Na2CO3、Cu2O、Fe2(SO4)3这四种物质中选出一种物质(甲),甲物质能使上述还原过程发生。
 ①写出并配平该氧化还原反应的方程式:
①写出并配平该氧化还原反应的方程式:
 ②反应中若产生0.2mol气体,则转移电子的物质的量是
mol。
②反应中若产生0.2mol气体,则转移电子的物质的量是
mol。
 ③若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
③若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
 。
。
17. (8分)工业上对海水资源综合开发利用的部分工艺流程如下图所示。
(8分)工业上对海水资源综合开发利用的部分工艺流程如下图所示。
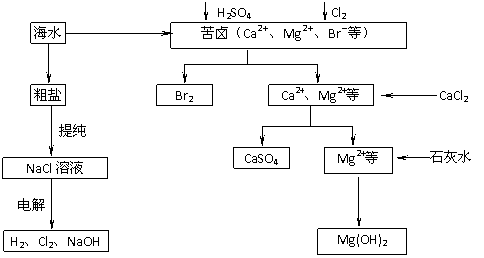











 (1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子是 。电解槽中的阳极材料为 。
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子是 。电解槽中的阳极材料为 。
 (2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
,原因是
。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
,原因是
。
 (3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是
。
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是
。
16. (10分)B是A水解的产物之一,相对分质量为75,是两性物质,B在人体内可转化为C排出体外。D是六元环状化合物,相对分子质量为126,其氢元素的核磁共振氢谱只有一个峰。3分子Q可以聚合成D,D与Q的最简式相同。①与④分别是工业生产的重要反应。X与Y是单质,E的焰色反应呈黄色。I是干燥剂与可以作建筑材料,I与G都是由两种元素组成的离子化合物,且离子个数比都为1:1。各种物质转化时的部分反应物与产物没有列出。
(10分)B是A水解的产物之一,相对分质量为75,是两性物质,B在人体内可转化为C排出体外。D是六元环状化合物,相对分子质量为126,其氢元素的核磁共振氢谱只有一个峰。3分子Q可以聚合成D,D与Q的最简式相同。①与④分别是工业生产的重要反应。X与Y是单质,E的焰色反应呈黄色。I是干燥剂与可以作建筑材料,I与G都是由两种元素组成的离子化合物,且离子个数比都为1:1。各种物质转化时的部分反应物与产物没有列出。
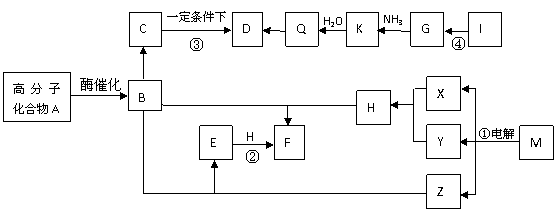







 回答下列问题:
回答下列问题:
 (1)写出D分子的结构简式__________________________。
(1)写出D分子的结构简式__________________________。
 (2)写出G物质的电子式____________________________。
(2)写出G物质的电子式____________________________。
 (3)关于A、B、C、K的叙述正确的是_____________。
(3)关于A、B、C、K的叙述正确的是_____________。
 a.A肯定是有机物
b.B的同分异构体只有4种
a.A肯定是有机物
b.B的同分异构体只有4种
 c.C与H2O不能发生化学反应
d.K物质中肯定含有氮元素
c.C与H2O不能发生化学反应
d.K物质中肯定含有氮元素
 (4)写出反应④的化学方程式______________________________________________。
(4)写出反应④的化学方程式______________________________________________。
 (5)写出E与H反应产生F的离子方程式_____________________________________。
(5)写出E与H反应产生F的离子方程式_____________________________________。
15. (12分)纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。
(12分)纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。
 已知:① 在潮湿空气中CaO2能够发生反应:
已知:① 在潮湿空气中CaO2能够发生反应:
 CaO2+2H2O → Ca(OH)2+H2O2
CaO2+2H2O → Ca(OH)2+H2O2
 2CaO2+2CO2 → 2CaCO3+O2
2CaO2+2CO2 → 2CaCO3+O2
 ② CaO2与稀酸反应生成盐和H2O2:CaO2+2H+ →Ca2++H2O2
② CaO2与稀酸反应生成盐和H2O2:CaO2+2H+ →Ca2++H2O2
 在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
 其制备过程如下:
其制备过程如下:
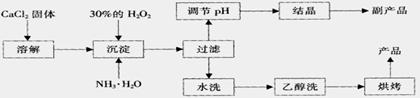




 根据以上信息,回答下列问题:
根据以上信息,回答下列问题:
 (1)用上述方法制取CaO2·8H2O的化学方程式是
;
(1)用上述方法制取CaO2·8H2O的化学方程式是
;
 (2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 ;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 ;
 (3)该制法的副产品为
(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。
(3)该制法的副产品为
(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。
 A.盐酸
B.氨水 C.稀硫酸 D.氢氧化钠溶液
A.盐酸
B.氨水 C.稀硫酸 D.氢氧化钠溶液
 (4)为了检验“水洗”是否合格的方法是
(4)为了检验“水洗”是否合格的方法是
 。
。
 (5)测定产品中CaO2的含量的实验步骤是:
(5)测定产品中CaO2的含量的实验步骤是:
 第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
 第二步:向上述锥形瓶中加入几滴淀粉溶液。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
 第三步:逐滴加入浓度为c mol/L的Na2SO3溶液至反应完全,消耗Na2S2O3溶液V mL。
第三步:逐滴加入浓度为c mol/L的Na2SO3溶液至反应完全,消耗Na2S2O3溶液V mL。
 [已知:I2+2S2O32-= 2I-+S4O62-(无色)]
[已知:I2+2S2O32-= 2I-+S4O62-(无色)]
 ①第三步中说明反应恰好完全的现象是
;
①第三步中说明反应恰好完全的现象是
;
 ②CaO2的质量分数为
(用字母表示);
②CaO2的质量分数为
(用字母表示);
 ③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“不受影响”、“偏低”或“偏高”),原因是
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“不受影响”、“偏低”或“偏高”),原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com