
题目列表(包括答案和解析)
14.
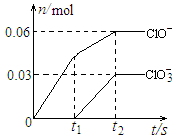 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是
 A.苛性钾溶液中KOH的质量是4.94g
A.苛性钾溶液中KOH的质量是4.94g
 B.反应中转移电子的物质的量是0.21mol
B.反应中转移电子的物质的量是0.21mol
 C.氧化性ClO-<ClO3-
C.氧化性ClO-<ClO3-
 D.ClO3-的生成是由于温度升高引起的
D.ClO3-的生成是由于温度升高引起的

 第Ⅱ卷 (共72分)
第Ⅱ卷 (共72分)
13. 下列溶液中有关微粒的物质的量浓度关系正确的是( )
下列溶液中有关微粒的物质的量浓度关系正确的是( )
 A、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
A、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
 c(Na+)>c(Cl-)>
c(CH3COOH)
c(Na+)>c(Cl-)>
c(CH3COOH)
 B、等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
B、等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
 C(Na+)> C(K+)> C(SO42-)> C(HS-)> C(OH-)>C(H+)
C(Na+)> C(K+)> C(SO42-)> C(HS-)> C(OH-)>C(H+)
 C、在0.1mol·L-1NaHSO3溶液中有c(Na+)= c(HSO3-)+
c(SO32-) +c (H2SO3)
C、在0.1mol·L-1NaHSO3溶液中有c(Na+)= c(HSO3-)+
c(SO32-) +c (H2SO3)
 D、pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A)
D、pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A)
12. 2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。

|
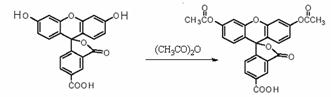

 下列说法不正确的是( )
下列说法不正确的是( )
 A.荧光蛋白遇CuSO4溶液发生盐析
A.荧光蛋白遇CuSO4溶液发生盐析
 B.5-FAM的分子式为:C21H12O7
B.5-FAM的分子式为:C21H12O7
 C.5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,消耗的氢氧化钠物质的量相同
C.5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,消耗的氢氧化钠物质的量相同
 D.荧光蛋白水解可获得多种氨基酸
D.荧光蛋白水解可获得多种氨基酸
11. 下列离子方程式书写正确的是( )
下列离子方程式书写正确的是( )
 A .向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至Al3+完全沉淀
A .向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至Al3+完全沉淀
 Al3++SO42-+Ba2++3OH- = Al(OH)3↓+ BaSO4↓
Al3++SO42-+Ba2++3OH- = Al(OH)3↓+ BaSO4↓
 B.碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HC03-+OH-=BaC03↓+H20
B.碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HC03-+OH-=BaC03↓+H20
 C.高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛:
C.高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛:
 6MnO4-+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH-+10H2O
6MnO4-+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH-+10H2O
 D.用惰性电极电解硫酸铜溶液:Cu2++4H2O
= Cu+4H++O2↑
D.用惰性电极电解硫酸铜溶液:Cu2++4H2O
= Cu+4H++O2↑
10. 著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是( )
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是( )
 A.铈的冶炼步骤为:用稀土串级萃法对矿石进行筛选富集;电解熔融Ce02。
A.铈的冶炼步骤为:用稀土串级萃法对矿石进行筛选富集;电解熔融Ce02。
 B.Ce02铈溶于氢碘酸的化学方程式可表示为:Ce02+4HI=CeI4+2 H2O
B.Ce02铈溶于氢碘酸的化学方程式可表示为:Ce02+4HI=CeI4+2 H2O
 C.用Ce(S04)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
C.用Ce(S04)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
 D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同位素
D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同位素
9. 下列说法中正确的是
下列说法中正确的是
 A.雪碧等碳酸型饮料的PH小于7,晃动后打开瓶盖,PH将变小
A.雪碧等碳酸型饮料的PH小于7,晃动后打开瓶盖,PH将变小
 B.晶体在发生物理变化时,也有可能使化学键断裂
B.晶体在发生物理变化时,也有可能使化学键断裂
 C.HI、HBr、HCl、HF四种物质的沸点依次降低
C.HI、HBr、HCl、HF四种物质的沸点依次降低
 D.周期表中的非金属元素都位于主族
D.周期表中的非金属元素都位于主族
8. F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。已知XeF4与水可发生如下反应:
F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。已知XeF4与水可发生如下反应:
 ①6XeF4(s)+12H2O(l)==2XeO3(aq)+4Xe(g)+24HF(aq)+3O2(g)
△H=-a KJ/mol
①6XeF4(s)+12H2O(l)==2XeO3(aq)+4Xe(g)+24HF(aq)+3O2(g)
△H=-a KJ/mol
 ② XeF4(s)+2H2O(l)=Xe(g)+O2(g)+4HF(aq)
△H=-b KJ/mol
② XeF4(s)+2H2O(l)=Xe(g)+O2(g)+4HF(aq)
△H=-b KJ/mol
 ③3XeF4(s)+6H2O(l)=Xe(g)+2XeO3(aq)+12HF(aq)
△H=-c KJ/mol
③3XeF4(s)+6H2O(l)=Xe(g)+2XeO3(aq)+12HF(aq)
△H=-c KJ/mol
 其中有一半物质的量的XeF4与H2O发生反应②;另一半物质的量的XeF4与H2O发生反③。
其中有一半物质的量的XeF4与H2O发生反应②;另一半物质的量的XeF4与H2O发生反③。
 下列判断中正确的是
下列判断中正确的是
 A.XeF2分子中各原子均达到8电子结构 B.a=3b+c
A.XeF2分子中各原子均达到8电子结构 B.a=3b+c
 C.XeF4按题给的方式水解,反应中氧化剂和还原剂的物质的量之比为2∶1
C.XeF4按题给的方式水解,反应中氧化剂和还原剂的物质的量之比为2∶1
 D.XeF4按题给的方式水解,每生成4molXe,转移12mol电子
D.XeF4按题给的方式水解,每生成4molXe,转移12mol电子
 不定项选择题 (本题包括6小题,每小题4分,共计24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。)
不定项选择题 (本题包括6小题,每小题4分,共计24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。)
7. 常温下在下列溶液中,各组离子一定能够大量共存的是
常温下在下列溶液中,各组离子一定能够大量共存的是
 A.在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+
A.在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+
 B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
 C.在c(H+)=10-12
mol·L-1的溶液:K+、Ba2+、Cl-、ClO -
C.在c(H+)=10-12
mol·L-1的溶液:K+、Ba2+、Cl-、ClO -
 D.能使碘化钾淀粉试纸变蓝的无色溶液:K+、Fe2+、SO42-、Cl-
D.能使碘化钾淀粉试纸变蓝的无色溶液:K+、Fe2+、SO42-、Cl-
5.工业上可用下列反应来制取纯硅:
 反应①:Si(粗硅)+3HCl(g)=SiHCl3(l)+H2(g) 反应②:SiHCl3(l)+H2(g)
= Si(纯硅)+3HCl(g)假设在每一轮次的投料生产中,硅元素无损失,反应①中HCl的利用率为60%,反应②中H2的利用率为80%。则下一轮次的生产中,需补充投入HCl 和H2的体积比为
反应①:Si(粗硅)+3HCl(g)=SiHCl3(l)+H2(g) 反应②:SiHCl3(l)+H2(g)
= Si(纯硅)+3HCl(g)假设在每一轮次的投料生产中,硅元素无损失,反应①中HCl的利用率为60%,反应②中H2的利用率为80%。则下一轮次的生产中,需补充投入HCl 和H2的体积比为
 4 :1 B. 8:1 C. 2:3
D. 3:5
4 :1 B. 8:1 C. 2:3
D. 3:5
 6
6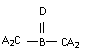
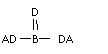 .A、B、C、D四种短周期元素,其核电荷数依次增大,已知元素A和D可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍。则下列由四种元素形成的化合物的化学式不正确的是
.A、B、C、D四种短周期元素,其核电荷数依次增大,已知元素A和D可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍。则下列由四种元素形成的化合物的化学式不正确的是
 A.B2A6CD2 B. C. D.B2A5D2C
A.B2A6CD2 B. C. D.B2A5D2C

4.欲用下表中乙栏所给的试剂,来检验(在实验过程中不允许加热、过滤、萃取……等操作)溶液中的离子X,在同时有离子Y存在时,此检验仍可进行的是( )
|
|
试剂乙 |
离子X |
离子Y |
|
A |
HNO3、Ba(NO3)2 |
SO42- |
SO32- |
|
B |
NH3.H2O |
Al3+ |
Mg2+ |
|
C |
AgNO3 |
Cl- |
I- |
|
D |
NH4SCN,氯水 |
Fe3+ |
Fe2+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com