
题目列表(包括答案和解析)
2.下列离子方程式正确的是
A.氯气通入水中: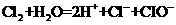
B.用铜电极电解饱和氯化钠溶液: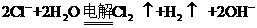
C.向 溶液中通入过量
溶液中通入过量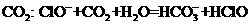
D.向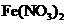 稀溶液中加入盐酸:
稀溶液中加入盐酸: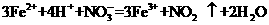
1.日常生活中遇到的很多问题都涉及到化学知识,下列有关叙述不正确的是
A.利用纯碱水解显碱性的特点可洗涤餐具上的油污
B.可利用湿淀粉遇碘变蓝的特性来检验含碘盐中的碘酸钾
C.食醋可用来清洗热水瓶中的水垢,是因为醋酸比碳酸的酸性强
D.国宝铜铸的牛首熠熠生辉而无铜绿,因为其组成可能为铜合金
29.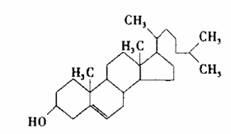 (16分)人体中有多种胆固醇,其总量大约占体重的0.2%,某种胆固醇X的结构简式为:
(16分)人体中有多种胆固醇,其总量大约占体重的0.2%,某种胆固醇X的结构简式为:
(1)下列对胆固醇X的叙述正确的是_________(填选项的编号)
a.可以使溴的四氯化碳溶液褪色
b.可以发生银镜反应
c.遇FeCl3溶液呈现紫色
d.不能发生氧化反应
(2)胆固醇X与有机物A、B、C、D、E、F间有如下转化关系:
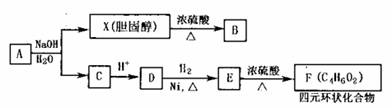
其中D能发生银镜反应,1molD与2molH2反应生成1molE。
① 有机物D中所含的官能团是___________________。
② X→B可能的反应类型是__________________。
③ E→F的化学方程式是____________________________________。
④ 写出与E具有相同官能团的所有同分异构体的结构简式:
28.(16分)根据化学反应2NH3+3CuO 3Cu+N2+3H2O,某课外小组利用下图装置测定Cu的相对原子质量。(图中夹持、固定装置已略去)
3Cu+N2+3H2O,某课外小组利用下图装置测定Cu的相对原子质量。(图中夹持、固定装置已略去)
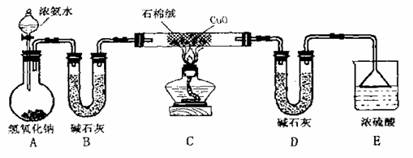
回答下列问题:
(1)实验步骤
① 按图连接好装置并检验气密性。
② 称取CuO粉末m1g置于硬质玻璃管内的石棉绒上,装有碱石灰的装置D的质量为m2g,其它装置按图所示装好药品。
③ 打开分液漏斗旋塞,点燃酒精灯。
④ 当观察到装置C中出现_________现象时,熄灭酒精灯,几分钟后,再关闭分液
漏斗旋塞。
⑤ 反应结束后测得装置D的总质量为m3g。
(2)问题与讨论
① 装置E的作用____________________________________________________
② Cu的相对原子质量(用含m1、m2、m3的代数式表示)______________。
③如果去掉B装置,则测定结果将______________(填“偏大”、“不变”、“偏小”)
(3)实验反思
课外小组同学认为装置C中CuO粉末是否完全反应是实验的关键。实验结束后,
请设计一种实验方案,用化学方法证明CuO粉末已完全反应:____________。
27.(13分)中学化学常见物质A-J之间的转化关系如下,其中反应①、②、③是工业上制备I的主要反应原理。已知A-J中除物质C外均含甲元素,A为淡黄色粉末,C由两种元素组成,其原子个数比为1:2,D是生活中常用的一种盐。
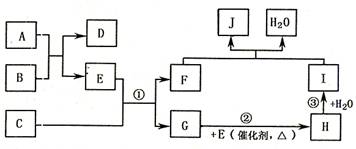
(1)甲元素的名称是___________,工业上制备I的方法叫做______________。
(2)D与J的溶液混合后的现象是________________________。
(3)F与碘化氢溶液反应的离子方程是_______________________。
(4)已知12g化合物C在E中完全燃烧放出85.3kJ热量,请写出表示C的燃烧热的热化学方程式: 。
26.(15分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
> ;
(2)A、B、C形成的化合物的晶体类型为 ;电子式为 ;
(3) 写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式 ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式 ;
(6)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式 .
13.混合下列各组物质使之充分反应,将所得混合物加热蒸干,并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.向KI、NaBr溶液中通入过量氯气
B.向CuSO4溶液中加入适量铁粉
C.向AlCl3溶液中加入过量NaOH溶液
D.向(NH4)2SO4溶液中加入等体积、等物质的量浓度的BaCl2溶液
12.观察下列模型并结合有关信息进行判断,下列说法错误的是 ( )
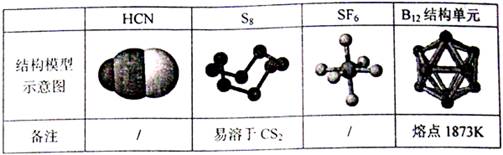
A.HCN的结构式为H-C N
N
B.固态硫S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属原子晶体,结构单元中含有30个B-B键,20个正三角形
11.用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.25℃时,1LpH=13的NaOH溶液中含有NA个氢氧根离子
B.4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子
C.1mol羟基(-OH)所含的电子数为10NA
D.标准状况下,测得一定量的铜与硝酸反应生成22.4L的混合气体,则被还原的硝酸的分子数应等于NA
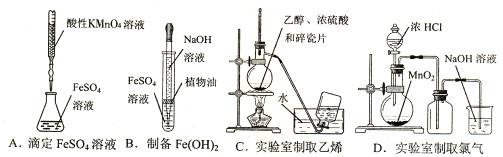
10.下列实验仪器使用及操作正确的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com