
题目列表(包括答案和解析)
5、在实验室中,下列实验室药品的保存方法正确的是①白磷保存在冷水中②Na、K保存在水里③HF溶液保存在塑料瓶中④AgNO3固体保存在棕色试剂瓶内⑤浓硝酸保存在棕色广口瓶内( )
A、①③④ B、③④ C、①②③④ D、①②③④⑤
4、有一瓶无色气体可能含有CO2、HBr、HCl、SO2中的一种或几种,将此气体通入稀氯水中,恰好反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化的氯化钡溶液和由硝酸酸化的硝酸银溶液,均出现沉淀,由此得出以下结论中正确的是( )
①原气体中肯定有SO2 ②原气体中可能有SO2 ③原气体中肯定没HBr ④不能确定原气体中有无HCl ⑤ 原气体中可能没有CO2 ⑥原气体中肯定有HCl
A.②③④⑤ B.①③④⑤ C.①③④⑥ D.②③⑤⑥
3、用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是( )

2、下列说法正确的是( )
A.滴定管洗净并经蒸馏水润洗后,即可注入标准液进行滴定
B.加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量
C.称量时,可将氢氧化钠固体放在纸片上称量
D.用玻璃棒蘸取待测溶液滴到湿润的pH试纸上,测其pH
1、下列混合物的分离或提纯操作中不正确的是( )
A.除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B.除去Fe(OH)3胶体中混有的Cl- 离子,可用渗析的方法
C.除去乙醇中的少量NaCl,可用蒸馏的方法
D.重结晶、滴定操作都可用于提纯物质
21.选做题
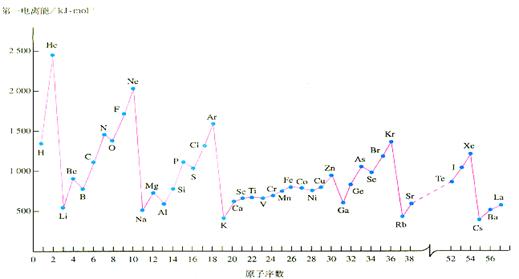 A.(12分)教材中给出的各物质的第一电离能的数据如下
A.(12分)教材中给出的各物质的第一电离能的数据如下
请回答下列问题:
(1)稀有气体的第一电离能都处在峰顶,碱金属的第一电离能都处在谷底,原因是:______________________________________________________________。
稀有气体中的Xe能形成氧化物XeO3,已知该氙原子上有1对孤对电子,则XeO3分子构型为_____型结构;Xe的杂化类型为__________________。碱金属的晶胞类型为钾型,其晶胞名称叫:__________________,它的空间利用率比铜型的___________(填:高、低)。
(2)上图中也给出了过渡元素的第一电离能数据,他们都与核外电子的排布有关,则Cr的外围电子排布式为:____________________________________。
(3)Mn 元素的外围电子排布式为3d54s2 ,Fe元素的外围电子排布式为3d64s2 ,请解释Mn的第三电离能比Fe的第三电离能大的原因是:____________________________。
(4)从上图中可以看出N原子的第一电离能与O第一电离能出现了反常现象,这与N原子的核外电子排布的特殊性有关,这样就使氮的单质及化合物具有一些特殊的性质,请回答下列问题:①写出一种与N2互为等电子体的阴离子的路易斯结构式_________________________.③向硫酸铜的溶液中加入少量氨水,产生蓝色的沉淀,继续加氨水则形成________色的透明溶液,其阳离子的结构为________________________(要表示出配位键),若加入极性较小的溶剂乙醇,将析出__________色的晶体,该物质的化学式为:_________________。
B.用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
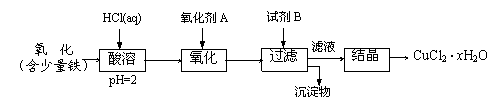
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
(1)加热酸溶过程中发生反应的离子方程式有:
_______________________________________________________________________
(2)氧化剂A可选用_______(填编号,下同)
 ①
Cl2 ② KMnO4 ③ HNO3
①
Cl2 ② KMnO4 ③ HNO3
(3)要得到较纯的产品,试剂B可选用_______
① NaOH ② FeO ③ CuO
(4)试剂B的作用是_______
① 提高溶液的pH ② 降低溶液的pH ③ 使Fe3+完全沉淀 ④ 使Cu2+完全沉淀
(5)从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序填编号)
① 过滤 ② 蒸发浓缩 ③ 蒸发至干 ④ 冷却
(6)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止、冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是______,据此计算得x = _____________(用含m、n的代数式表示)。
20.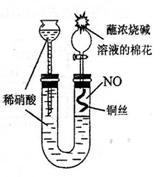 (9分)某同学对Cu与HNO3的反应进行如下探究。请回答有关问题。
(9分)某同学对Cu与HNO3的反应进行如下探究。请回答有关问题。
⑴用右图所示装置制取NO,验证U型管中生成的气体是NO的实验
方法是 。
⑵将0.64g Cu全部溶于一定量的浓HNO3中,测得生成气体0.009mol(含NO、NO2和N2O4),共消耗HNO3 0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。
①计算空气中参加反应的O2在标准状况下的体积为 mL。
②计算0.009 mol 混合气体中N2O4的物质的量(写出计算过程)。
19.
 (10分)已知方框内是食品香精菠萝酯的生产路线,A、C 又能发生方框外所示的转化关系。A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O
(10分)已知方框内是食品香精菠萝酯的生产路线,A、C 又能发生方框外所示的转化关系。A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O
信息:-OH和碳碳双键不能连在同一个碳原子上
根据所给信息完成以下问题:
⑴写出指定的结构简式:B ; E 。
⑵反应①属于 反应(填反应类型);反应②分两步进行的条件是:① ② ;
⑶1mol菠萝酯最多能与
mol H2发生加成反应
⑷写出生成高分子F的化学方程式:

⑸写出满足下列条件的B的同分异构体:属于酯类;能使FeCl3溶液显色;且苯环上的一氯代物只有两种结构的有
、
、
、
(有几种填写几种)
16.(9分)根据下列框图回答有关问题(答题时,方程式中的E用所对应的元素符号表示):
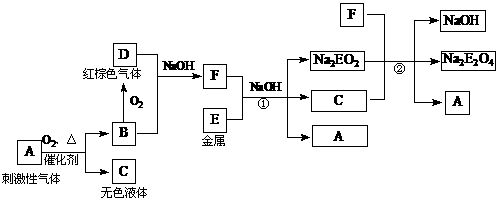
已知:Na2EO2溶于过量的新制氯水,形成黄色溶液,向该溶液中滴加KSCN溶液立即出现红色,振荡,一段时间后,红色褪去。
⑴A的电子式为 。
⑵写出反应②的化学方程式 。
⑶写出Na2EO2与新制氯水反应的离子方程式 。
⑷一段时间后红色褪去的原因可能是:
①E元素被氯水氧化为更高价态的物质;② 。
(5)一定条件下Na2E2O4可被氧化成Na2EO4 ,该物质可用于饮用水的处理理由是
|


|

 Cr3+
Cr(OH)3
CrO2-
Cr3+
Cr(OH)3
CrO2-
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬原子核中质子数为24,铬位于周期表中第_______周期_______族。
(2)FeSO4还原Cr2O72-的离子方程式为_______________________________________。
(3) Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为_______________。
(4)沉淀法分离废水中的Cr3+离子,pH应控制在 范围内。
(5)下列关于铬及其化合物的说法中正确的是 。
A.K2Cr2O7是一种常用的强氧化剂 B.NaCrO2溶液与AlCl3溶液混合有沉淀生成
C.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车 D.Cr(OH)3为两性氢氧化物
E.金属铬硬度大、耐腐蚀,是常用的镀层金属
(6)冶炼铬工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
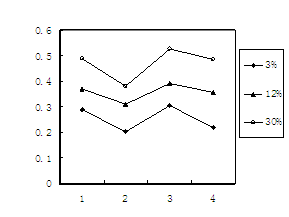
说明:1为用蒸馏水浸溶,2为用稀硫酸浸溶,3为冻融后用蒸馏水浸溶,4为曝晒后用蒸馏水浸溶;
3%、12%、30%为制砖时含铬废渣掺入的比例。
已知我国规定“固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得下列结论正确的是: 。
A.其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高
B.酸性环境对Cr元素浸出有抑制作用 C.冻融对Cr元素浸出影响不明显
D.曝晒对Cr元素浸出影响不明显 E.上述砖样符合我国排放标准
18(8分).研究金属的冶炼对人类有重要意义。
(1)人类历史上大量生产和使用钠、铝、铁、铜四种金属单质的时间从先到后顺序是____ __
(2)铜的冶炼有火法冶炼和湿法冶炼写出火法炼铜的化学方程式(Cu2S为主原料)
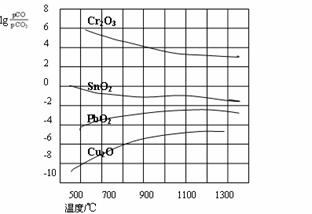 (3)右图是部分金属氧化物被一氧化碳
(3)右图是部分金属氧化物被一氧化碳
还原时lg[p(CO)/p(CO2)]与温度的关
系曲线图。则四种金属氧化物中:
Cr2O3、SnO2、PbO2、Cu2O,最易
被还原的金属氧化物是 ,
该反应的△H 0。
(4)下列说法正确是
A.氧化镁跟铝粉共热适于炼镁
B.不锈钢中含有金属和非金属元素
C.所有金属均以化合态存在于自然界
D.金属冶炼中还原剂可以是一些活泼金属
E.活泼金属的冶炼都是通过电解其盐溶液制得
F.金属提炼一般要经过矿石的富集、冶炼、精炼三步
15.(12分)纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:
① 在潮湿空气中CaO2能够发生反应:CaO2+2H2O → Ca(OH)2+H2O2 2CaO2+2CO2 → 2CaCO3+O2
② CaO2与稀酸反应生成盐和H2O2:CaO2+2H+ →Ca2++H2O2
在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
其制备过程如下:
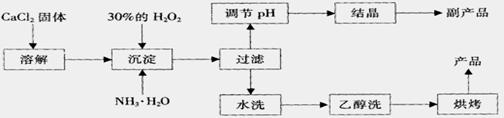
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 ;
(3)该制法的副产品为 (填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
(4)为了检验“水洗”是否合格的方法是
(5)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
[已知:I2+2S2O32-= 2I-+S4O62-(无色)]
①第三步中说明反应恰好完全的现象是 ;
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com