
题目列表(包括答案和解析)
1.下列关于元素周期表的说法错误的是:
A.元素周期表是元素周期律的具体表现形式
B.是先有元素周期律,再有元素周期表的
C.中学课本上的元素周期表是常用的一种形式,也是唯一的一种形式
D.元素周期律是指元素的性质随着原子序数的递增而呈周期性的变化的规律
12.(18分)某有机物A只含C、H、O三种元素,可用作染料、医药的中间体,具有抗菌、祛痰、平喘作用。A的蒸气密度为相同状况下氢气密度的77倍,有机物A中氧的质量
分数约为41.6%,请结合下列信息回答相关问题。
①A可与NaHCO3溶液作用,产生无色气体;
②1 molA与足量金属钠反应生成H2 33.6 L(标准状况);
③A可与FeCl3溶液发生显色反应;
④A分子苯环上有三个取代基,其中相同的取代基相邻,不同的取代基不相邻。
请回答:
(1)A的分子式是 A中含氧官能团的名称是
(2)写出A与NaHCO3溶液反应的化学方程式:
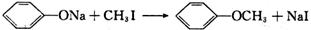 (3)已知:
(3)已知:
a.

b.
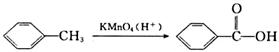
c.
有机物B的分子式为C7H6O2,在一定条件下发生如下转化,最终生成A:

请回答:①反应Ⅱ的化学方程式是
②上述转化中,反应I、Ⅱ两步的作用是
③B可发生的反应有 (填字母)。
a.取代反应 b.加成反应 C.消去反应 d.水解反应
(4)芳香族化合物F与A互为同分异构体,可发生银镜反应,1 mol F恰好与含3 molNaOH
的溶液作用,其苯环上的一卤代物只有一种。写出F的一种可能的结构简式 。
11.(14分)将水蒸汽和CO气体分别通入到体积为1 L的恒容密闭容器中进行反应。
H2O(g)+CO(g) CO2(g)+H2(g);DH。得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);DH。得到以下三组数据,据此回答下列问题:
|
|
|
起始量 |
平衡量 |
|
||
|
实验组 |
温度 |
H2O |
CO |
H2 |
CO2 |
达到平衡所需时间 |
|
l |
650℃ |
1 mo1 |
2 mol |
0.8 mol |
0.8 mol |
5 min |
|
2 |
900℃ |
0.5 mo1 |
l mo1 |
0.2 mo1 |
0.2 mol |
3 min |
|
3 |
900℃ |
amol |
bmo1 |
cmo1 |
dmol |
t |
(1)由以上数据,实验l中以v(CO2)表示的反应速率为 mol/(L×min)。
(2)比较该反应实验1和实验2中CO的转化率:α1 α2;该反应的反应热DH 0。
(两空填“>”、“=”或“<”)
(3)若实验3要达到与实验2等效的平衡状态,且t< 3 min,则a、b应满足的关系是
(4)900°C时,若要重新达到平衡,使c(CO2)/c(CO)比值变小,在其他条件不变时,可
采取的措施有(填字母)
A.使用高效催化剂 B.增大H2浓度 C.升高温度 D。缩小容器体积
10.(14分)某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分泥污,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。

(1)步骤l的主要操作是 ,需用到的玻璃仪器除烧杯外还有
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是 (填化学式)
(3)步骤2中在分离Hg和固体残渣时,采用在封闭体系中加热、冷凝回收的方法,原
因是
(4)步骤3之后在B中加入液体混合物X(稀H2SO4和一种绿色氧化剂),仅生成硫酸铜
和水,反应方程式是
(5)步骤4中涉及的操作是:蒸发浓缩、 、过滤、烘干。
9.(14分)有四种短周期元素Y、M、Z、X,其原子序数依次增大,其微粒结构或性质特点如下表:
|
元素编号 |
元素微粒结构或性质特点 |
|
x |
标准状况下X2的密度为3.17 g/L |
|
Y |
原子最外层电子数为次外层电子数的2倍 |
|
Z |
最高价氧化物E是通讯材料光导纤维的主要原料 |
|
M |
0.l mol/L M的最高价氧化物的水化物N的水溶液pH=13 |
(1)M离子的离子结构示意图为: ;
(2)Y形成一种可用作装饰品的单质,其晶体的熔点与Z单质比较,熔点较高的是
(填化学式),Z最高价氧化物晶体类型是 。
(3)写出N与X2单质反应的离子方程式:
(4)以石墨和铁作电极,用电解槽电解化合物MX的水溶液,阳极产生X2,铁应
作 极,若该电极逸出1.12 L(标准状况)气体,则电路中转移电子 mol。
8.室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合前后的体积变化)( )
|
|
① |
② |
③ |
④ |
|
pH |
12 |
12 |
2 |
2 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(C1-)>c(NH4+)>c(OH-)>c(H+)
D.熔溶液②和溶液③等体积混合,混合后所得溶液pH=7
7. 右图是778K时N2与H2反应过程中能量变化的曲线图,
右图是778K时N2与H2反应过程中能量变化的曲线图,
下列叙述正确的是( )
A.此反应N2+3H2 2NH3为吸热反应
2NH3为吸热反应
B.加入催化剂,该化学反应的DH变大
C.b曲线是加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速率,逆反应速率不变
5.下列做法存在安全隐患的是( )
①将水沿着烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌;②实验室制取氯气结束时,先撤水中的导管后撤酒精灯;③取用金属Na或K时,剩余的药品要放回原瓶;④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,并打开所有的门窗通风;⑤干冰是干粉灭火器的常见成分,可用作镁、铝等金属的灭火;⑥做苯酚性质实验时,因为常温时苯酚在水中的溶解度较小,所以可以将废液直接排入下水道。
A.①④⑤⑥ B.①②③④ C.①③④⑤ D.全部
 6.右图中,两电极上发生电极反应。a极:Cu2++2e-=Cu,b极:Fe-2e-==Fe2+下列说法不正确的是( )
6.右图中,两电极上发生电极反应。a极:Cu2++2e-=Cu,b极:Fe-2e-==Fe2+下列说法不正确的是( )
A.装置中电解质溶液一定含有Cu2+
B.该装置一定是化学能转化为电能
C.a极上一定发生还原反应 D.a、b可能是同种电极材料
4.下列说法正确的是( )
A.二氧化碳分子内存在非极性共价键和分子间作用力
B.甲烷、氨和水都是由极性键结合而成的极性分子
C.同主族不同元素的最高价氧化物,一定具有相同的晶体结构
D.氟化氢的沸点高于氯化氢,正丁烷的沸点高于异丁烷
3.设NA为阿伏加德罗常数,下列有关叙述不正确的是( )
A.常温常压下,l mol甲基(-CH3)所含的电子数为10NA
B.0.4 mol任意比混合的乙炔和乙醛气体充分燃烧,消耗氧气分子数为NA
C.常温常压下,NA个甲烷分子的体积大于22.4 L
D.0.1mol Na2O2与足量的水反应,转移的电子数为0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com