
题目列表(包括答案和解析)
9.高温下,反应CO2+H2 CO+H2O 达到平衡。下列说法正确的是( )
A.恒容时,温度升高,H2浓度减小,该反应是焓变为正值
B.恒容时,温度升高,逆反应速率减小
C.恒温恒容下,增大压强,H2浓度一定减小
D.增加催化剂的质量,CO2的转化率升高
8.往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( )
A.该实验表明FeCl3有还原性 B.白色沉淀为BaSO3
 C.该实验表明SO2有漂白性 D.反应后溶液酸性增强
C.该实验表明SO2有漂白性 D.反应后溶液酸性增强
7.化学反应终点的判断是化学定量实验的重要环节。下列对化学反应终点的判断不正确的是 ( )
A.向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀
B.淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,
加热,若有砖红色沉淀生成,说明淀粉已经完全水解
C.将Na2SO4·10H2O晶体置于坩埚中加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水
D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,说明NaOH已完全中和
6.下列关于环境、健康和发展的叙述中,不正确的是( )
A.光导纤维是以二氧化硅为主要原料制成的
B.硫酸工业尾气未经处理就直接排放,将直接导致“温室效应”
C.一些有效成分为碳酸钙的补钙剂需嚼烂服用,目的在于加快消化吸收
D.铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀
26.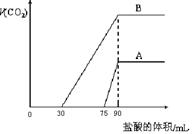 取两份等浓度的NaOH溶液A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
取两份等浓度的NaOH溶液A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
(1)原NaOH溶液的物质的量浓度为 mol·L-1
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式) ;其物质的量之比为 。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸产生CO2气体体积(标准状况)的最大值为 mL。
25. 某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度。现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品。
某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度。现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品。
(1)实验时除需测定粗锌的质量、氢气的体积之外,还需要测定 。
(2)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是:________________(请填写步骤代号)。
(3)如果实验中测得粗锌质量为a g,得到的氢气体积是b L(已折算成标准状况),水蒸气的影响忽略不计,粗锌中锌的质量分数的计算式为(含a、b,不必化简):_____________________________________。
(4)试根据上述仪器,提出更简捷的实验方案:_____________________________________________________________。
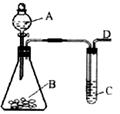
24.某同学用如图所示的装置来探究SO2的性质及有关实验。
(1)实验前应先检验装置的气密性,方法是
。
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式
。
(3)将制取的SO2气体通入C溶液中,请回答下列问题:
①若C溶液是紫色石蕊试液,通入少量SO2气体后,现象是 ,继续通入过量的SO2气体,现象是 。
②若C溶液是橙色的溴水溶液,通入SO2气体后现象是 ,写出反应的离子方程式 。
③若C溶液是澄清石灰水,缓慢且持续通入SO2气体过程中,观察到的现象是 。
23.火力发电厂燃煤排烟,释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体。这些气体直接排放到空气中,将造成环境污染。为解决排烟污染问题,某发电厂采用如下措施,对燃煤烟气进行脱硝、脱硫和脱碳等处理,实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);△H=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);△H= -1160kJ·mol-1

 则甲烷直接将NO2还原为N2的热化学方程式为:___________________________________________。
则甲烷直接将NO2还原为N2的热化学方程式为:___________________________________________。
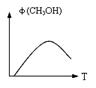
(2)脱碳。将二氧化碳转化为甲醇:CO2+3H2 CH3OH(g)+H2O(g);
写出该反应平衡常数K= 。
右图表示某次合成实验中甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线,则上述二氧化碳转化为甲醇反应的△H 0(填 >、 =、或 <)。
(3)脱硫。用碳酸钙作吸收剂与水配制成浆液,在吸收塔中洗涤烟气并吸收SO2,得到石膏(CaSO4·2H2O)。
电厂第一季度用煤300t(煤中含有硫2.8%),若燃烧时煤中的硫全部转化成二氧化硫,且吸收脱硫过程中80%的硫转化为转化为石膏,则第一季度可生产石膏_________________吨。
(4)最新处理技术是用纳米型氧缺位铁酸盐(MFe2OX 3<x<4,M=Mn、Co等金属)来处理燃煤排烟。常温条件下,纳米型氧缺位铁酸盐能使烟气中的酸性氧化物转化为单质,自身被氧化为MFe2O4。已知:93.2g纳米型氧缺位铁酸锌(ZnFe2OX)能处理含SO2 0.01%的尾气22400L(标准状况),则ZnFe2OX中的x=_________。
22.已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是 ,判断理由是 。
(2)写出其余几种物质的化学式:A B C
(3)写出实验②中有关反应的离子方程式 。
21.根据表中左栏信息,回答右栏有关问题:
|
信 息 |
问 题 |
|
①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数。其中X是形成化合物种类最多的元素。 |
(1)X的最高价氧化物的结构式为 。 |
|
②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液。 |
(2)Z元素的氧化物溶于浓NaOH溶液的离子方程式:
|
|
③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成。 |
(3)写出生成白色沉淀的化学方程式 |
|
④W的最高价氧化物的水化物不溶于水,但可溶于NaOH溶液。 |
(4)W的最高价氧化物的水化物可溶于NaOH溶液的离子方程式为
。 |
|
(5)X、Y、Z、W四种元素的原子半径由大到小的顺序为
(用元素符号表示) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com