
题目列表(包括答案和解析)
7.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是: ( )
A.16.9 g BaO2固体中阴、阳离子总数约为0.3×6.02×1023
B.2.3 g 钠被O2完全氧化时,失去电子数约为0.1×6.02×1023
C.0.5 mol超重水(T2O)的质子总数约为5×6.02×1023
D.标准状况下,11.2 L甲烷与乙烯的混合物所含氢原子的数目约为2×6.02×1023
31.[化学-有机化学基础]
图中A、B、C、D、E、F、G均为有机化合物,其中A、B都属于芳香族化合物。
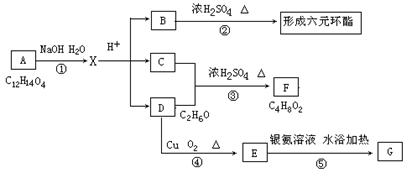
根据上图回答问题:
(1)A、B的相对分子质量之差是 ,B的分子式是 。
(2)图中属于取代反应类型的是(用序号表示) 。
(3)写出反应③、⑤的化学方程式:
③ 。
⑤ 。
(4)B的同分异构体有多种,其中同时符合下列条件的同分异构体有 种,写出其中任一种同分异构体的结构简式 。
①与FeCl3溶液显紫色
②与NaHCO3溶液反应产生无色气体
③ 是苯环的二元取代物。
30.
|
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。
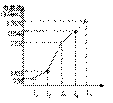
回答下列问题:
(1)X原子的电子排布式为______________________。
(2)电负性:X ______Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。有关该Z2H4分子的说法正确的是_________________。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.Z的原子与氢原子形成的化学键可以旋转
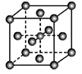
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构示意图(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围_________(填数字)个氧离子相紧邻。
(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是______________。
A.离子键 B.非极性键 C.配位键 D.金属键
25.电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
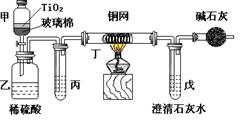
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是___________(填字母)
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是 。
装有碱石灰的干燥管的作用是 。
(4)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于________________。
请说明该测得值与实际处理的百分率相比偏高还是偏低_________?简要说明可能的原因
。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂)
。
24.工业炼铝是用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的主要原料氧化铝,然后进行电解。工艺流程如下图:
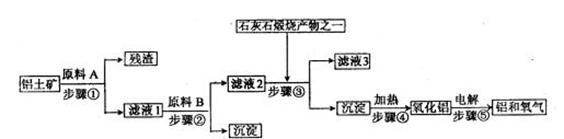
(1)滤液1中要加入稍过量的原料B,原料B的化学式是 。写出步骤②有关反应的离子方程式
、 。
(2)如果省去步骤①,即溶解铝土矿从直接加入原料B开始,则最终会对氧化铝的生成有什么影响?
。
(3)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,其中 极的材料随反应的进行需要不断补充,为什么? 。
(4)铝粉与三氧化二铁粉末在引燃剂作用下常用来焊接钢轨,主要是利用了该反应 ,而且该反应焊接速度快、设备简易,适于野外作业。
23.请按要求回答问题:
Ⅰ.短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A、B、C三种元素形成的简单离子的半径由大到小的顺序是 。
(2)CA2与D元素的单质在水溶液中反应的化学方程式是 。
Ⅱ.在25℃时,用石墨电极电解100mL 1 mol·L-1 AgNO3溶液,如有0.2mol电子发生转移,试回答下列问题:
(1)阴极上发生的电极反应为 。
(2)电解产生的气体的总体积(标准状况)为 。
Ⅲ.已知298K时下列反应:
Ca(s)+C(s)+3/2O2(g)===CaCO3(s);△H=-1206.8 kJ·mol-1
Ca(s)+1/2O2(g)===CaO(s);△H=-635.1 kJ·mol-1
Ca(s)===CaO(s)+CO2(g);△H=+178.2 kJ·mol-1
则该温度下12g C完全燃烧的热化学方程式为 。
Ⅳ.短周期元素A、B、C、D在周期表中位置如图所示, 其中元素D原子最外层有3个电子。

(1)C的单质能使湿润的有色布条褪色,使布条褪色的物质化学式是 。
(2)元素A的某种氧化物和氧气在KOH溶液中可构成燃料电池,该电池工作时正极的电极反应式为 。
(3)D的氧化物与NaOH溶液反应的化学方程式是 。
(4)B的单质与氢气在 1L密闭容器中进行反应,进行到2min时,氢气物质的量减少了0.15mol。则2min内消耗B单质的平均反应速率是 。
(5)B的氢化物与C的氢化物反应产生白烟,此反应产物的水溶液中各种离子物质的量浓度的大小顺序是
。
(6)D单质的某种反应可用于焊接钢轨,该反应的化学方程式是 。
12.下列溶液中离子浓度关系表示正确的是
A.NaHCO3溶液中:c(H+) + c(Na+)=c(OH-) + c(CO32-) + c(HCO3-)
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)<c(OH-)
C.0.1mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH) + c(CH3COO-)
第Ⅱ卷
11.将SO2气体与足量Fe2 ( SO4 )3溶液完全反应后, 再加入K2Cr2O7溶液,发生如下两个化学反应:
SO2 + 2Fe3+ + 2H2O ==== SO42– + 2Fe2+ + 4H+
Cr2O72– + 6Fe2+ + 14H+ === 2Cr3+ + 6Fe3+ + 7H2O 。下列有关说法正确的是
A.还原性:Cr3+>SO2 B.氧化性:Cr2O72–>SO2>Fe3+
C.Cr2O72– 能将Na2SO3氧化成Na2SO4 D.两个反应中Fe2 ( SO4 )3均作还原剂
10.下图是制取、洗涤并测量生成气体体积的装置示意图。
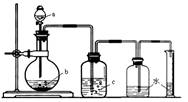
利用上述装置进行下表所列实验,能达到试验目的的是
|
物质 实验 |
a(液体) |
b(固体) |
c(液体) |
|
A |
稀盐酸 |
锌粒 |
浓H2SO4 |
|
B |
浓氨水 |
生石灰 |
浓H2SO4 |
|
C |
浓硫酸 |
Cu片 |
NaOH溶液 |
|
D |
稀HNO3 |
Cu片 |
H2O |
9.下列各组离子在指定环境中一定大量共存的是
A.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、Cl-、Al3+、NO3-
B.在pH=13的溶液中:K+、SO32-、S2-、Na+
C.在由水电离出的c(H+)=1×10-13 mol·L-1的溶液中:Fe3+、Cl-、Na+、SO42-
D.在pH=1的溶液中:NO3-、SO42-、Fe2+、Na+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com