
题目列表(包括答案和解析)
27.[长春实验中学2009高三理科综合练习化学部分试题(二)]氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是 ( )
A.35Cl原子所含质子数为18
B.3.5 g的35Cl2气体的体积为2.24 L
C.1/18 mol的1H35Cl分子所含中子数约为6.02×1023
D.35Cl2气体的摩尔质量为71 g/mol
[解析]:原子序数=质子数=电子数=核电荷数,A错;B错,因为没有指明温度和压强;35Cl2气体的摩尔质量为70 g/mol,D错;
[答案]:C
26、[ 连云港新海高级中学09届高三化学九月质量检查试题]同温同压下,对于等体积的一氧化氮(14N18O)和一氧化碳(13C18O)气体,下列说法正确的是:
A.含相同的分子数和原子数 B.含相同的分子数和电子数
C.含相同的质子和中子数 D.所含分子数和质量均不相同
[解析]:根据阿伏伽德罗定律,n(14N18O)=n(13C18O), N(14N18O)=N(13C18O), 14N18O含有的电子数是15、质子数15、中子数17;13C18O含有的电子数是14、质子数14、中子数17;
[答案]:A
25、[2009年上学期浙江绍兴中学学科综合检测试题化学.6]X元素的离子X2-,核外电子数为m,中子数为n,wg X的氢化物中的电子为( )mol
A、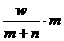 B、
B、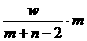 C、
C、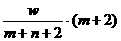 D、
D、
[解析]:X2-的质子数是m-2,质量数是m+n-2, wg X的氢化物的物质的量是
wg/(m+n-2+2)g.mol-1= w/(m+n)mol,所以电子的物质的量是mw/(m+n)mol.
[答案]:A
24.[甘肃省兰州一中2008-200高三上学期第三次月考.24]X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
Z+W
(1)Y的电子式是 _。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是 。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
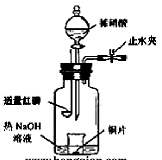 b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分
液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作
是 。
②红磷充分燃烧的产物与NaOH溶
液反应的离子方程式是 。
③步骤c滴入稀硝酸后烧杯中的现
象是 。反应的离子
方程式是 。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1----T2之间,反应的化学方程式是 。
②温度在T2----T3之间,气体的平均相对分子质量是(保留1位小数)
。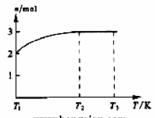
 [解析]:根据题干信息推断X、Y、Z、W分别是NH4+、OH-、NH3、H2O;根据图像中物质的量的变化可知发生如下变化,N2O4
2NO2 2NO2=2NO+O2
[解析]:根据题干信息推断X、Y、Z、W分别是NH4+、OH-、NH3、H2O;根据图像中物质的量的变化可知发生如下变化,N2O4
2NO2 2NO2=2NO+O2
M=92/3=30.7
[答案]:(1) 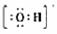
 (2)2NH3(l) NH2-+NH4+
(2)2NH3(l) NH2-+NH4+
(3) ①打开止水夹,通入少量氧气
②P2O5+6OH-=2PO43-+3H2O
③Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色
3Cu+8H++2NO3-=3Cu2++2NO +4H2O
+4H2O
(4) ①2NO2=2NO+O2
②30.7
23. (江苏省口岸中学09届秋学期高三年级第二次月考)两种微粒的质子数和电子数都相等,它们不可能是
A.一种阳离子和一种阴离子 B.一种原子和一种分子
C. 一种单质分子和一种化合物分子 D. 一种分子和一种离子
[解析]:两种微粒的质子数和电子数都相等,则两种粒子的所带电量和电性必须相等。
[答案]:AD
22.[上海市2009届高三年级上学期十四校联考]目前人类认为钚(94Pu)是最毒的元素,其一种原子的中子数是质子数的1.596倍。该原子的质量数为
A.94 B.150 C.244.024 D.244
[解析]:94Pu的质子数是94,中子数是1.596×94=150,所以质量数是150+94=244.
[答案]:D
21.(广东潮州市金山中学高三化学08年10月考试)某金属最高价氟化物的相对分子质量为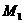 ,其最高价的硫酸盐的相对分子质量为
,其最高价的硫酸盐的相对分子质量为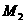 ,若此元素的最高正价为n,则n与
,若此元素的最高正价为n,则n与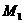 、
、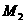 的关系可能是( AB )
的关系可能是( AB )
A.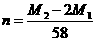 B.
B.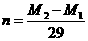 C.
C.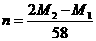 D.
D.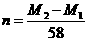
[解析]:因为金属元素的化合价可能是偶数也可能是奇数,设金属的相对原子质量为X,当是奇数时,氟化物和硫酸盐的化学式分别是MFn和M2(SO4)n ,X+19n=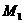 ,2X+96n=M2
,则
,2X+96n=M2
,则
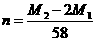 ;当是偶数时,,氟化物和硫酸盐的化学式分别是MFn和M(SO4)n/2,
;当是偶数时,,氟化物和硫酸盐的化学式分别是MFn和M(SO4)n/2,
X+19n=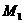 ,X+48n=M2,则
,X+48n=M2,则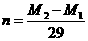
[答案]:AB
20.(广东省中山一中09届高三第一次统测 )下列指定微粒的个数比为2:1的是
A.Be2+离子中的质子和电子
B.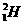 原子中的中子和质子
原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
[解析]:Be2+离子的质子数是4,电子数是2,A正确;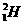 原子质子数是1,中子数是1,B错;NaHCO3晶体和BaO2晶体中的阳离子和阴离子比都为1:1,CD错;
原子质子数是1,中子数是1,B错;NaHCO3晶体和BaO2晶体中的阳离子和阴离子比都为1:1,CD错;
[答案]:A
19. ( 2008-2009学年度徐闻一中高三化学第三次测)美国科学家分析海水沉积物时发现,北大西洋和太平洋海水中的 和 (元素钕)的含量差异明显,由此得出周围大陆的岩石中 和 含量不同的结论。下列有关说法正确的是( D )
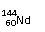
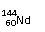
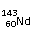
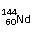
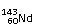
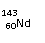 A、 和 互为同素异形体;
A、 和 互为同素异形体;
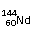
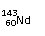 B、元素Nd是主族元素
B、元素Nd是主族元素
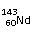
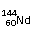 C、 和 中中子数和质子数均不相同;
C、 和 中中子数和质子数均不相同;
D、因各地岩石中 和 含量不同,所以Nd元素没有固定的相对原子质量
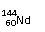
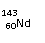 [解析]:同素异形体的研究对象是同种元素的不同单质,A错;60-54=4,所以Nd位于第6周期第ⅢB族,属于副族元素,B错;
和
质子数相等,中子数不等,C错;
[解析]:同素异形体的研究对象是同种元素的不同单质,A错;60-54=4,所以Nd位于第6周期第ⅢB族,属于副族元素,B错;
和
质子数相等,中子数不等,C错;
[答案]:D
18.(广东省实验中学2008学年高三第二次阶段测试试卷 )原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关x的说法中不正确的是 ( A )
A.X能形成化学式为X(OH)3的碱
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
[解析]:根据n的取值范围,n=1、2、3,再根据核外电子排布规律,X是N或Cl元素,
[答案]:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com