
题目列表(包括答案和解析)
13.
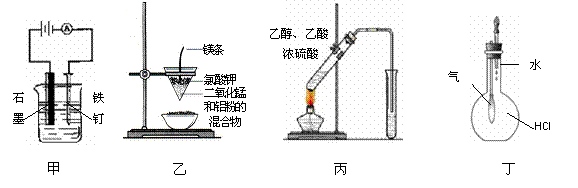 用下列实验装置进行的实验中,不能达到相应实验目的的是
用下列实验装置进行的实验中,不能达到相应实验目的的是
A.装置甲:防止铁钉生锈 B.装置乙:可制得金属锰
C.装置丙:实验室制取乙酸乙酯 D.装置丁:验证HCl气体在水中的溶解性
12.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1LpH=2的盐酸溶液中含有的阳离子数为0.02NA
B.100g98%的浓硫酸中含氧原子个数为4NA
C.标准状况下,22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
D.1 molC20H42分子中,含有的共价键数目为61NA
11.下列实验过程中产生的现象与对应的图形符合的是
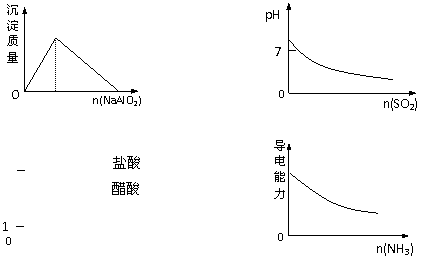
A.盐酸中加入NaAlO2溶液 B.SO2气体通入溴水中
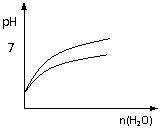
C.pH=1的醋酸与盐酸分别加水稀释 D.氨气通入醋酸溶液中
10.T ℃时,N2与H2反应生成NH3,其能量变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1 ℃和T2 ℃时,H2的体积分数与时间的关系如图(Ⅱ)所示。则下列结论不正确的是

A.该反应的热化学方程式: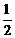 N2(g)+
N2(g)+
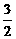 H2(g)=NH3(g);△H = (a+b)kJ·mol-1
H2(g)=NH3(g);△H = (a+b)kJ·mol-1
B.该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1);△H = 2(a-b-c)kJ·mol-1
C. T1>T2,且正反应为放热反应
D. 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大
9.恒温25℃时,将两铂电极插入一定量硫酸钠饱和溶液中进行电解。通电一段时间后,阳极析出了a mol气体,同时有ωg Na2SO4·10H2O晶体析出。剩余溶液中溶质的质量分数为
A.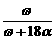 ×100% B.
×100% B.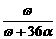 ×100% C.
×100% C.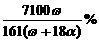 D.
D. 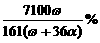
8.下列对实验现象的解释与结论正确的是
|
编号 |
实验操作 |
实验现象 |
解释与结论 |
|
A |
向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液 |
有白色沉淀产生 |
蛋白质发生了变性 |
|
B |
向某溶液中加入BaCl2溶液 |
有白色沉淀产生 |
生成难溶于水的BaSO4,该溶液中一定含有SO42- |
|
C |
向甲苯中滴入少量浓溴水,振荡,静置 |
溶液分层,上层呈橙红色,下层几乎无色 |
甲苯和溴水发生取代反应,使溴水褪色 |
|
D |
向蔗糖中加入浓硫酸 |
变黑,放热,体积膨胀,放出刺激性气体 |
浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
7.下列离子方程式书写不正确的是
A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性
2H+ + SO42- + Ba2+ + 2OHOHOHOH- = BaSO4↓+ 2H2O
B.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中
2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 6Cl- + 2Br2
C.碳酸氢铵溶液中加入足量NaOH溶液
NH4++ HCO3-+2OH- = CO32-+NH3·H2O+H2O
D.向澄清石灰水中加入过量的碳酸氢钠溶液
Ca2+ + 2OHOHOHOH- + 2HCO3-= CaCO3↓ + 2H2O + CO32-
6.下列各组离子:(1) I-、ClO-、NO3-、Cl-; (2) K+、H+、NO3-、Cl-;
(3)SO32-、S2-、Cl-、OH-; (4)Mg2+、Cu2+、SO42-、Cl-; (5)Fe3+、SCN-、K+、SO42-;
(6)K+、HPO42-、PO43-、HSO3- 。在溶液中能大量共存的组别共有
A.1组 B.2组 C.3组 D.不少于4组
5. 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。下列有关说法正确的是
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。下列有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.用金属铝与V2O5反应冶炼钒,铝作还原剂
C.已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2
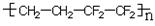 D.ETFE膜(
)是由两种单体缩聚而成的
D.ETFE膜(
)是由两种单体缩聚而成的
4.已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: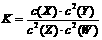 ,有关该平衡的说法中正确的是
,有关该平衡的说法中正确的是
A.升高温度,平衡常数K变大 B.增大压强,W(g)物质的量分数变大
C.升温,若混合气体的平均相对分子质量变小,则正反应放热
D.增大X浓度,平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com