
题目列表(包括答案和解析)
该类试题常考查化学平衡状态的确认、反应特征及有关的变化和概念等。
 例1.向甲乙两个容积均为1L的恒容容器中分别充入
例1.向甲乙两个容积均为1L的恒容容器中分别充入
2molA、2molB和1molA、1molB。在相同条件下,发生反应:A(g)+B(g)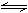 xC(g);△H<0。测得两容器中C(A)随时间t的变化如右图所示,则下列说法中正确的是
( )
xC(g);△H<0。测得两容器中C(A)随时间t的变化如右图所示,则下列说法中正确的是
( )
A.达到平衡时,容器甲中气体的密度是容器乙中气体密度的2倍。
B.若将乙容器单独升温可以使乙容器内各物质的体积分数与甲容器内的相同。
C.保持温度不变,再向容器甲中充入2molA、2molB,达到新平衡时,甲容器中C(A)为1.56mol/L。
D.x可能等于2也可能等于3。
解析:容器内混合气体的密度=混合气体的总质量/容器的体积,因甲、乙两容器的体积相等,且A、B、C三种物质均为气态,由题意知甲容器中气体的总质量不论何种状态都是乙容器中的2倍,故容器甲中气体的密度恒为容器乙中气体密度的2倍。故选项A正确;利用“容器转化法”可知x等于1,故选项D错误,也可由“等效平衡法”证明选项D错误,因若x≥2,则甲容器中平衡时C(A)≥1mol/L;由平衡移动原理知:保持温度不变,再向容器甲中充入2molA、2molB,达到新平衡时,甲容器中0.78mol/L<C(A)<1.56mol/L,所以选项C错误;若将乙容器升温,平衡左移,C的物质的量减小,但总物质的量增多,故容器内各物质的体积分数一定不会与甲容器内的相同,所以选项B错误。所以正确答案是:A。
[点评]:该题目的设计形式采用与数学图形相结合,解答时要通过分析图像中有关化学量的变化等,来确定化学反应的特性,如判断反应热效应或外界条件对反应的影响及反应的特征等。
8.以上各部分知识与技能的综合应用。
[试题分析]
本题是以测定黄铜中锌的质量分数为基础的评价改进型综合考题,(1)-(4)小题分别考核了根据化学实验的目的和要求,运用相关的化学知识和技能对实验的药品的选择、对实验装置或实验数据的选择、实验装置的组装顺序等知识点,考查的内容较基本,但题目的综合思考性较强,较全面地考查了学生识别仪器能力、实验能力、分析能力、解决具体问题的能力
第(5)小题考核实验评价,联系到初中氢气还原氧化铜的实验,暗藏玄机
7.根据实验试题要求,设计和评价实验方案。
6.根据实验现象,观察、记录、分析或处理数据,得出正确结论。
4.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
3.掌握化学实验的基本操作。
化学实验
1.了解化学实验常用仪器的主要用途和使用方法。
2.实验能力
(2)观察记录实验现象,处理实验数据和分析实验结果,得出正确结论的能力。
(4)能识别和绘制典型的实验仪器装置图的能力。
(5)根据实验试题的要求,设计或评价简单实验方案的能力。
[例题6]氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是
A.该反应既是分解反应,又是氧化还原反应
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:
5C12+I2+6H2O=12H++10Cl-+2IO3-
C.若化学计量数a=8,b=3,则该反应转移电子数为20e-
D.氯酸分解所得O2和Cl2的物质的量之比是确定不变的
解析: O2和HClO4是氧化产物,C12是还原产物,生成HClO4的多少不同会导致反应所得O2和C12的物质的量之比的变化
答案:D
[例题7]某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法不正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若80y(1-a/3)≥b≥160y/3,则金属和硝酸恰好完全反应
D.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
14.BD解析:A中,滴加硫酸后,溶液中的NO3-在酸性条件下,能氧化剩余的金属.B中,当金属全部溶解时,铁元素可能以Fe2+的形式存在,不一定含Fe3+,B不正确。C中,根据反应式:3Cu+8HNO3=Cu(NO3)2
+2NO↑+4H2O ;3Fe+8HNO3=Fe(NO3)2+2NO↑+4H2O 。Fe+4HNO3=Fe(NO3)3+NO↑+2H2O ,利用极限法,当金属与硝酸恰好完全反应时,80y(1-a/3)≥b≥160y/3 ,C正确。D中,当b=0.3时,参加反应的硝酸为0.05×0.3=0.015mol,而生成的NO的物质的量为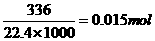 ,参加反应的硝酸的物质的量应该大于生成NO的物质的量,D不正确。
,参加反应的硝酸的物质的量应该大于生成NO的物质的量,D不正确。
[例题8]问题提出:小王同学有次实验时把SO2通入装有BaCl2、FeCl3的混合溶液的试管中,出现了白色浑浊物
假设、验证:
|
|
假设 |
实验验证方法及现象 |
|
假设1 |
白色浑浊物是BaSO3。 |
(1)_____________________________
__________________________________ |
|
假设2 |
(2)白色浑浊物是BaSO4,主要原因是
 |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊。滴加FeCl3溶液后出现浑浊 (4)通入纯净的CO2的目的_______________ |
请把上表填充完全.
(5)写出SO2通入BaCl2、FeCl3的混合溶液生成沉淀相关的离子方程式。
(a)
(b)___________________________________________________
|

(1) 在白色浑浊物中加入过量盐酸,变澄清 (1分)
(1分)
(2) Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4(1分)
(3)防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 (2分)
(2分)
(4) (a) SO2 +2Fe3++2H2O =SO42-+2Fe2++4H+(2分)
|

(二)考虑问题不周全失误
[例题3]将4.9克Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是 ( )
A. 6g B. 8g C. 10g D. 10.2g
解题思路:最后沉淀质量=OH-质量+金属质量。由题意可知,金属虽说全溶解,但铁还没有全被氧化成三价铁,加足量的NaOH在空气中不断搅拌,Fe(OH)2 将全部被氧化,所以生成的沉淀一定为Mg(OH)2、Fe(OH)3 ,不可能有Fe(OH)2 .在此还要注意的是,整个过程中既有硝酸得电子又有氧气得电子。硝酸得的电子有关系式NO3‑ -NO-3e- 为0.3mol,如再加上空气中氧气得的电子,那么整个过程中得电子数肯定大于0.3 mol,为此金属失去的电子数也大于0.3mol.由于金属阳离子电荷总数等于金属离子结合的OH- 数.由 e--OH-可得金属离子结合的OH-也大于0.3mol.则最后沉淀大于4.9+0.3×17=10g,即生成沉淀大于10g ,选择题中至少必须有一个选项符合要求,本题正确答案只能选D
答案:D
易错警示:本题最容易受思维定势影响,没有注意HNO3量不足,溶液中有Fe2+,后加NaOH溶液就要考虑空气中O2氧化Fe(OH)2 忽视了这一点,而错C选项。因此考虑问题要全面,要仔细分析整个变化过程。
[例题4]用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH值(不考虑二氧化碳的溶解)。则电解过程中共转移的电子数为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
解题思路:加入的物质是Cu2 (OH)2CO3(2CuO·CO2·H2O)要使电解后的溶液复原,必然涉及两个反应:2CuSO4+2H2O  2H2SO4+2Cu+O2↑, 2H2O
2H2SO4+2Cu+O2↑, 2H2O  2H2↑+O2↑,加入0.1mol Cu2 (OH)2CO3,这就要电解出0.2mol Cu后再单独电解0.1mol H2O,根据氧化还原反应中电子得失相关系,转移电子总数为:0.1×2+0.2×2=0.6mol电子
2H2↑+O2↑,加入0.1mol Cu2 (OH)2CO3,这就要电解出0.2mol Cu后再单独电解0.1mol H2O,根据氧化还原反应中电子得失相关系,转移电子总数为:0.1×2+0.2×2=0.6mol电子
答案:C
易错警示:对题给信息要仔细分析,加入Cu2 (OH)2CO3可将其化学式写成2CuO·CO2·H2O,这样就很容易看出,相当于有水加入,整个过应为先有2CuSO4+2H2O  2H2SO4+2Cu+O2↑,再电解水。由此可见,审题中考虑问题要周全,这样才能减少解题失误。
2H2SO4+2Cu+O2↑,再电解水。由此可见,审题中考虑问题要周全,这样才能减少解题失误。
[例题5]用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH值(不考虑二氧化碳的溶解)。则电解过程中共转移的电子数为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
解题思路:加入的物质是Cu2 (OH)2CO3(2CuO·CO2·H2O)要使电解后的溶液复原,必然涉及两个反应:2CuSO4+2H2O  2H2SO4+2Cu+O2↑, 2H2O
2H2SO4+2Cu+O2↑, 2H2O  2H2↑+O2↑,加入0.1mol Cu2 (OH)2CO3,这就要电解出0.2mol Cu后再单独电解0.1mol H2O,根据氧化还原反应中电子得失相关系,转移电子总数为:0.1×2+0.2×2=0.6mol电子
2H2↑+O2↑,加入0.1mol Cu2 (OH)2CO3,这就要电解出0.2mol Cu后再单独电解0.1mol H2O,根据氧化还原反应中电子得失相关系,转移电子总数为:0.1×2+0.2×2=0.6mol电子
答案:C
易错警示:对题给信息要仔细分析,加入Cu2 (OH)2CO3可将其化学式写成2CuO·CO2·H2O,这样就很容易看出,相当于有水加入,整个过应为先有2CuSO4+2H2O  2H2SO4+2Cu+O2↑,再电解水。由此可见,审题中考虑问题要周全,这样才能减少解题失误
2H2SO4+2Cu+O2↑,再电解水。由此可见,审题中考虑问题要周全,这样才能减少解题失误
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com