
题目列表(包括答案和解析)
25.氯乙烯是合成聚氯乙烯的单体。乙烯氧化法是生产氯乙烯的主要方法。分三步进行,如下图所示:
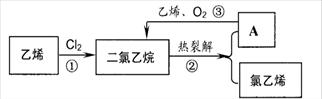
(1)关于乙烯、氯乙烯、聚氯乙烯说法正确的是__________(填字母)
A.都能在氧气中燃烧 B.都能发生加成反应。使溴水褪色
C.都能使得酸性高锰酸钾褪色 D.氯乙烯分子中所有原子共平面
(2)从环境角度考虑,氧化法的优点是____________________
(3)某学生设计下列反应:请写出③化学方程式__________________
(4)已知二氯乙烷与氢氧化钠溶液供热可以生成乙二醇(HOCH2CH2OH),请写出乙二醇与乙酸完全发生反应的方程式__________________________________
(5)焚烧废旧塑料过程中会排放有毒物质。写出聚乙烯塑料完全燃烧的化学方程式
24.设反应①Fe(s)+CO2(g)⇋FeO(s)+CO(g)平衡常数K1;
反应②Fe(s)+H2O(g)⇋FeO+H2(g)平衡常数为K2
测得在不同温度下,K1、K2值如下:

(1)若5000c时进行反应①,CO2起始浓度为2mol.L-1,CO2转化率为__________。
(2)9000c进行反应③H2(g)+CO2(g)⇋H2O(g)+CO(g),其平衡常数K3为___________________
(3)反应②的焓变△H___0(填大于、小于、等于)。
(4)7000c反应②达到平衡,使得该平衡向右移动,其它条件不变时,可以采取的措施有______(填序号)
A.缩小反应器体积 B.加入水蒸气
C升高温度到9000c D.使用合适的催化剂
(5)下列图像符合反应①的是____ (填序号)(图中v是速率、∅为混合其中CO含量,T为温度)

23.高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。某研究小组设计了用工业废铁屑(含铜、碳、硅等)制取高铁酸钠的工艺流程,其中X、Y、Z是含铁化合物。
(1)废铁屑中加入碳酸钠热溶液的目的是_________________。
(2)试写出上述过程中X转化为Y的离子方程式_______________。
(3)写出Cl2将Z氧化为Na2FeO4的化学方程式_______________________。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理______________。
(5)高铁酸钠还可以用电解法:Fe+2NaOH+2H2O=Na2FeO4+2H2↑,写出电解时阳极的电极反应式_____________。
⑴ 清洗废铁屑表面的油污; (2)2Fe2+ + H2O2 + 2H+ ==2Fe3+ + 2H2O
(3)10NaOH + 3Cl2 + 2Fe(OH)3 == 2Na2FeO4 + 6NaCl + 8H2O
(4)高铁酸盐在杀菌消毒时,本身被还原成Fe3+,Fe3+易水解生成Fe(OH)3,具有胶体的性质,可吸附水中的悬浮杂质,而起到净化水的作用。(只答出Fe3+易水解生成Fe(OH)3,给1分) (5)Fe-6e-+8OH-=FeO42-+4H2O
22.广东省海水资源丰富,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32- 、HCO3- 等离子。合理利用水资源是持续发展的重要保证。
Ⅰ:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境问题。利用海水脱硫是一种有效地方法。其工艺流程如下图所示:
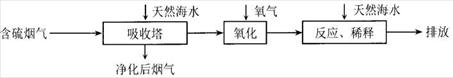
(1)天然海水pH≈8,弱碱性。用离子方程式解释原因是_________(任写一个)。
(2)天然海水吸收含硫烟气后,用氧气进行氧化处理,其原理化学反应方程式是______;氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是________。
Ⅱ:重金属离子对河流海洋造成严重污染。某化工废水(pH=2.0,d=1g.mL-1)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01mol.L-1,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中加入_________(填字母序号),沉淀效果最好。
A. NaON B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水。使溶液的pH=8,处理后废水中c(Pb2+)=______。
(5)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于10-8mol.L-1盐问该工厂处理后的废水中Ag+是否符合排放标准?要求写出计算过程。已知Ksp(AgCl)=1.8×10-10
Ⅰ: (每空2分,方程式错一处均不给分)
(1)CO32-+H2O HCO3-+OH-或 HCO3-+H2O
HCO3-+OH-或 HCO3-+H2O H2CO3 +OH-
H2CO3 +OH-
(2)2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42- (任写一个化学方程式或离子方程式均给分) 中和、稀释经氧气氧化后海水中生成的酸(H+)
Ⅱ:(3)B(2分) (4)1.2×10-3 mol·L-1(2分)
(5)处理后的废水中Cl-的物质的量浓度为:
C(Cl-)=  (2分)
(2分)
当反应达到AgCl的沉淀溶解平衡后,由Ksp(AgCl)=[Ag+]·[Cl-]可
[Ag+]=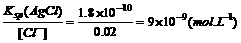
答:Ag+符合排放标准。(2分)
21.某碱式碳酸铜粉末加热可分解:Cu2(OH)2CO3·H2O2CuO+CO2+(x+1)H2O。现取适量(不称量其质量)该固体样品,完成下列实验。
Ⅰ测定该样品组成中结晶水x的值
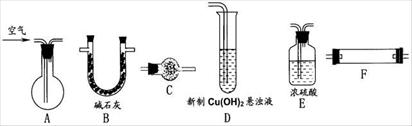
用图示仪器组装装置完成实验Ⅰ(加热、支持、连接等仪器在图中略去,仪器可重复使用)。
(1)组装仪器按气流方向从左到右连接的顺序为:
A-→_______-→_______-→_______-→_______-→_______C。
(2)干燥管C应装有______(试剂),作用是___________________;如果缺少C装置,测得的x的值会_____(填“偏大”、“偏小”或“无法确定”)。
Ⅱ:用实验Ⅰ分解后的残留固体完成乙醇的催化氧化实验,并验证其反应产物(已知乙醛和葡萄糖有相似的性质,检验方法相同)。
选用上述仪器也按气流方向从左到右连接的顺序为:A-→B-→F-→C-→D
(3)A中应装有_______ (试剂);C用于检验反应产物之一,C中应装有_______ (试剂)。
(4)要检验另一种反应产物,接下来的实验操作和现象是_________________________。
20.硬铝废料(含90%铝、2.5%镁、7.5%铜)可以制取明矾KAl(SO4)2.12H2O,某探究小组设计了下列实验。
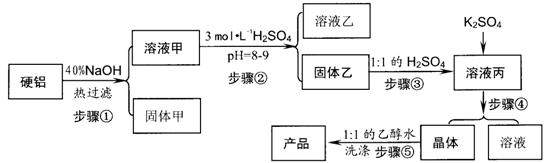
请回答以下问题:
(1)写出步骤②的离子方程式__________;简述用pH试纸的过程:__________。
(2)步骤④包括三个环节,分别是_______、_________、________。
(3)步骤⑤不直接用水洗的原因是_____________,洗涤的操作是____________。
(4)有人建议:直接将硬铝溶于稀硫酸中,过滤;滤液中加入硫酸钾得到溶液丙,在进行后续实验。请你评价此建议的可行性_____________________。
19.化学兴趣小组在实验中发现:将锌粒放入CuSO4溶液中一段时间,锌粒表面附着了一层松散的黑色粉末状物质,而不是预期的红色物质。通过查阅资料秀讨论,大家认为黑色物质可能由Cu、CuO和Zn组成。同学们以黑色物质进行探究。
Ⅰ.小组成员认为黑色物质中含有氧化铜,是反应过程中生成的Cu(OH)2分解产生的。请说明反应过程中产生Cu(OH)2的原因_______________________________________。
Ⅱ.兴趣小组对黑色粉末状物质的组成进行了实验探究。请完成下列实验报告。
限定实验仪器与试剂:1 g 黑色粉末、试管、玻璃棒、药匙、滴管、酒精灯、试管夹、稀H2SO4、浓HNO3、稀NaOH溶液、蒸馏水。
实验报告
(1)实验课题:探究黑色粉末的组成
(2)设计实验方案(不要在答题卡上作答)
(3)实验过程
|
实验操作 |
预期现象与结论 |
|
|
|
(4)实验讨论:根据以上探究结果,如果在锌与CuSO4溶液的知识中获得预期的红色物质,改进的方法是
___________________________________________________。
18.常温下,下列酸碱发生中和反应,有关判断正确的是C
A.同浓度的NaOH溶液与CH3COOH溶液等体积混合后,
c (CH3COO-)=c(Na+)>c(H+)=c(OH-)
B.pH=3的CH3COOH溶液与pH=11的KOH溶液等体积混合,
c(K+)>c (CH3COO-)>c(OH-)> c(H+)
C.pH=2的HNO3溶液与pH=12的NH3·H2O溶液等体积混合,
c(NH4+)+ c(H+)=c(OH-)+ c (NO3-)
D.pH=2的盐酸溶液与pH=11的NaOH溶液按体积比2:9混合,混合液pH=3.2
17.下列实验报告中,完全正确的是C
|
序号 |
实验操作 |
现象 |
结论 |
|
A |
向溶液中滴加用盐酸酸化的BaCl2溶液 |
有白色沉淀 |
原溶液中含SO42- |
|
B |
向溶液中滴加氯水后,再滴入KSCN溶液 |
溶液变红色 |
原溶液中含Fe3+ |
|
C |
向装有Na2O2的试管中加入水后,立即滴加酚酞试液 |
溶液先变红后褪色 |
Na2O2有漂白性 |
|
D |
向淀粉溶液中加入稀硫酸加热后,加入新制Cu(OH)2,加热 |
得到蓝色溶液 |
淀粉没有水解 |
16.在2L的密闭容器中,一定条件下发生化学反应:2NO(g) +2CO(g) 2CO2(g) + N2(g) △H=-746.4kJ/mol 。起始反应时NO和CO各为4mol,10秒钟后达到化学平衡,测得N2为1mol。下列有关反应速率的说法中,正确的是C
2CO2(g) + N2(g) △H=-746.4kJ/mol 。起始反应时NO和CO各为4mol,10秒钟后达到化学平衡,测得N2为1mol。下列有关反应速率的说法中,正确的是C
A.反应前5秒钟内,用NO表示的平均反应速率为0.1mol·(L·s)-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:V正(CO)=2 V逆(N2)
D.保持容器体积不变,往容器中充入1mol O2,正、逆反应速率都不改变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com