
题目列表(包括答案和解析)
4.下列实验操作完全正确的是
|
编号 |
实 验 |
操 作 |
|
A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定物质的量浓度的氯化钾溶液1000 mL |
准确称取氯化钾固体,放入到1000 mL的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
|
D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
3.已知通过乙醇制取氢气有如下两条路线:
 a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H=+255.6KJ. mol-1
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H=+255.6KJ. mol-1
 b.CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)△H=+13.8KJ. mol-1
b.CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)△H=+13.8KJ. mol-1
 则下列说法不正确的是
则下列说法不正确的是
 A.降低温度,可提高b路线中乙醇的转化率
A.降低温度,可提高b路线中乙醇的转化率
 B.从能量消耗的角度来看,b路线制氢更加有利
B.从能量消耗的角度来看,b路线制氢更加有利
 C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
 D.由a、b知:2 H2(g)+O2(g)==2
H2 O(g)△H=-483.6KJ. mol-1
D.由a、b知:2 H2(g)+O2(g)==2
H2 O(g)△H=-483.6KJ. mol-1
2.实验室里不宜长期放置,应在使用时才配制的试剂是
①酚酞试液 ②银氨溶液 ③Na2CO3溶液 ④Cu(OH)2悬浊液
⑤酸性FeCl3溶液 ⑥FeSO4溶液 ⑦NaCl溶液 ⑧氯水
A.②⑤⑥⑧ B.①③④⑤ C.①②⑤⑦ D.②④⑥⑧
1.信息、材料、能源被称为新科技革命的“三大支柱”。下列观点或做法错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机
27.(10分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素:
|
a |
|
b |
|||||||||||||||
|
|
|
|
|
|
c |
d |
|
|
|||||||||
|
e |
|
|
f |
|
|
|
g |
h |
|||||||||
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
j |
(1)i是 元素,请写出其基态原子的电子排布式 ;
(2)元素f与g比较,电负性较大的是 (填元素符号);
(3)元素d的氢化物分子的立体结构是 ,c的氢化物中c原子的杂化轨道类型是 ;
(4)g与e、g与f形成化合物的晶体类型分别是____________、______________;
(5)NH3·H2O的电离方程式为
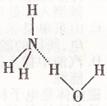
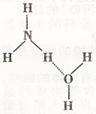 NH3·H2O
NH3·H2O NH4++OH-,试判断
NH4++OH-,试判断
NH3溶于水后,形成的NH3·H2O的
合理结构是 (填序号),
分析NH3极易溶于水的原因:
;
(A) (B)
26.(10分)环已烯常用于有机合成。现通过下列流程,以环已烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
已知:(i)R1―CH=CH―R2 R1―CHO+R2―CHO
R1―CHO+R2―CHO
(ii)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如:


(1)A的核磁共振氢谱图上峰的个数为 ,F的结构简式是 ;
(2)有机物B和I的关系为 (填序号,多填扣分);
A.同系物 B.同分异构体 C.都属于醇类 D.都属于烃
(3)写出下列反应类型:⑥ ,⑨ ;
(4)写出反应⑩的化学方程式: ;
(5)1mol有机物B 与足量CH3C18OOH在一定条件下完全反应时,生成的有机物的结构简式可能为(如有18O请标示) 。
25.(9分)糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖 ( C6H12O6)。下列说法不正确的是 (填序号);
A.糖尿病人尿糖偏高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
B.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)含糖类丰富的农产品通过发酵法可以制取乙醇,但随着石油化工的发展,工业上主要是以乙烯为原料,在加热、加压和有催化剂存在的条件下跟水反应生成乙醇,这种方法叫做乙烯水化法。试写出该反应的化学方程式: ,该反应的反应类型是 ;
(3)今有有机物A、B,分子式不同,均可能含C、H、O元素中的两种或三种。如果将A、B不论以何种比例混合,只要物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变。若A是甲烷,则符合上述条件的有机物B中分子量最小的是
(写化学式)。并写出分子量最小的含有-CH3(甲基)的B的两种同分异构体的结构简式 、 ;
(4)分析下表所列数据,可以得出的结论是(写出2条即可) 。
|
烷 基 |
氟化物 |
氯化物 |
溴化物 |
碘化物 |
|
沸点℃ |
沸点℃ |
沸点℃ |
沸点℃ |
|
|
CH3- |
-78.4 |
-24.2 |
3.6 |
42.4 |
|
CH3-CH2- |
-37.7 |
12.3 |
38.40 |
72.3 |
|
CH3-CH2-CH2- |
2.5 |
46.60 |
71.0 |
102.4 |
|
(CH3)2-CH- |
-9.4 |
35.7 |
59.48 |
89.14 |
|
CH3-CH2-CH2-CH2- |
32.5 |
78.44 |
101.6 |
130.5 |
|
(CH3)2-CH CH2- |
16.0 |
68.7 |
91.7 |
120.4 |
|
(CH3)3C- |
12.1 |
52 |
73.25 |
120.8 |
0.10 mol/L Na2CO3的滴定曲线如右图所示:
① A处选用 作指示剂比较合适;
② 当滴定至混合液pH接近4时,为了防止终点出现过早,减少实验的误差,应剧烈地摇动溶液或加热一会溶液,冷却后再继续滴定,这样做的理由是:
;
如果是采用加热溶液的操作,应如何进行?
;
(2)EDTA是乙二胺四乙酸的英文名称的缩写,它是一种常用的滴定剂,市售试剂是其二水合二钠盐。下表是EDTA与一些常见金属离子形成络合物(用MY表示)的稳定常数(温度25oC):
|
阳离子 |
lgKMY |
阳离子 |
lgKMY |
|
Na+ |
1.66 |
Mn2+ |
13.87 |
|
Ca2+ |
10.96 |
Pb2+ |
18.04 |
lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离
根据上表给出的数据和你所学的知识,解释为什么用CaY溶液可以排除体内的铅?
___________________________________________________________________________。
24.(12分)
I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)  2SO3(g)
;△H=-196.6kJ·mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932 kJ的热量,则容器A中SO2的平衡转化率为 ;容器B中SO2的平衡转化率(填“大于”、“小于”或“等于”) 容器A中SO2的平衡转化率;达到平衡的时间(填“A”或“B”) 容器比较短;
2SO3(g)
;△H=-196.6kJ·mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932 kJ的热量,则容器A中SO2的平衡转化率为 ;容器B中SO2的平衡转化率(填“大于”、“小于”或“等于”) 容器A中SO2的平衡转化率;达到平衡的时间(填“A”或“B”) 容器比较短;
 II.滴定分析法是化学分析法中的重要分析方法之一。滴定分析法就是将一种已知准确浓度的试剂溶液(即标准溶液),由滴定管滴加到被测定的物质的溶液(即试液)中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积,就可以求得被测组分的含量。
II.滴定分析法是化学分析法中的重要分析方法之一。滴定分析法就是将一种已知准确浓度的试剂溶液(即标准溶液),由滴定管滴加到被测定的物质的溶液(即试液)中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积,就可以求得被测组分的含量。
(1) 已知用0.10 mol/L HCl滴定 20.00ml
23.(13分)沸石是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道能让直径比孔穴小的分子通过而将大的分子留在外面,故又称“分子筛”。“分子筛”在表面化学中有重要作用,是重要的催化剂和催化剂载体。以高岭土(主要成分:Al2Si2O7·2H2O)、石灰石、海水为原料生产“分子筛”的工艺流程如下:

回答下列问题
(1)高岭土主要成分的化学式可表示为Al2O3·2SiO2·2H2O,则分子筛的化学式也可表示为 ;
(2)写出0.1mol/L副产品A溶液中有关离子浓度关系的两个等式:
、 ;
(3)气体M和滤液发生反应的任意一个离子方程式为:
;
(4)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56L(标准状况下)气体,电解后溶液体积为500L时,求所得溶液在常温时的pH值(要求写出解题过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com