
题目列表(包括答案和解析)
29.(15分)A为含有C、H、O三元素的芳香烃的衍生物,各物质问的相互关系如下图。又
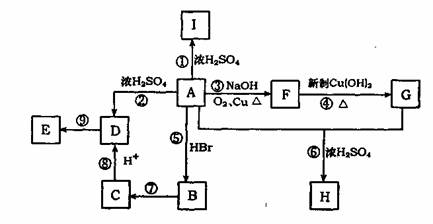 已知:ROH+HX
已知:ROH+HX RX+H2O;E为高分子化合物,分子式为(C9H8O2)n;H分子式为C18H15O6Na;I中含有一个苯环,还含有一个六元杂环。
RX+H2O;E为高分子化合物,分子式为(C9H8O2)n;H分子式为C18H15O6Na;I中含有一个苯环,还含有一个六元杂环。
回答下列问题:
(1)写出A的分子式 。I的结构简式 ;
(2)写出有关反应的反应类型:反应②为 ,反应⑤为: ,反应⑨为 ;
(3)反应⑥中浓H2SO4的作用是 ;
(4)写出反应④的化学方程式 ;
写出反应⑦的化学方程式 ;
(5)A的同分异构体有多种,写出符合下列条件的A的两种同分异构体的结构简式。
①A分子中有两个对位取代基;
②与FeCl3溶液能发生显色反应;
③能发生银镜反应。
和 。
28.(18分)某学习小组为测定市售过氧化钠纯度,设计了如下方案:
 实验原理:2Na2O2+2H2O==4NaOH+O2↑(杂质不参与反应)
实验原理:2Na2O2+2H2O==4NaOH+O2↑(杂质不参与反应)
仪器装置:如右图。
实验步骤:
①称取过氧化钠样品2.00g;
②把过氧化钠样品放入气密性良好的
气体发生装置锥形瓶中
(固体体积忽略不计);
③向过氧化钠样品中滴加水,用量气装
置测得气体体积为166.00mL(已换算
成标准状况);
④锥形瓶中液体体积为54.00mL;
⑤将锥形瓶内液体全部转移入仪器A中,并定容至250.00mL;
请回答下列问题:
(1)仪器A的名称: ;
(2)生成气体的体积为 mL;为保证测定气体体积的准确性,测定时必须做到:
① ;② ;③视线与凹液面最低点持平。
(3)据报导,该反应还会有副反应:
Na2O2+2H2O===2NaOH+H202
H2O2生成,会使测定结果 (“偏高”、“偏低”、“无影响”)
如何避免因生成H2O2造成的误差: ;
(4)为效正实验结果.该小组补做了如下实验:
用滴定管量取20.00mL。A中的液体放人锥形瓶中,用0.010mol/L.的H2SO4酸化的高锰酸钾溶液滴定至终点,用去12.00ml.高锰酸钾溶液。其反应为:(未配平)
KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2+H2O
①滴定时高锰酸钾溶液应装在 中(填仪器名称)。
②此实验未使用指示剂,如何确定终点:
③由上述实验测定数据,计算该过氧化钠样品纯度(写出计算过程)。
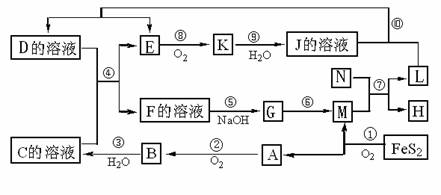
27.(14分)下图是多种无机物在一定条件下的转化关系(部分产物及反应条件未列出。)K是形成光化学烟雾及形成酸雨的一种主要气体,N为第三周期元素组成的单质熔点最高的金属,X是一种矿石的主要成份,常用来生产一种常见的化工产品。
回答:
(1)在周期表,组成单质L的元素位于第 周期第 族。
(2)K的名称为 ,G的化学式 ;
(3)已知X的燃烧热为853KJ/mol,写出反应①的热化学方程式:
(4)写出反应⑤的离子方程式:
写出⑩的离子方程式:
(5)反应⑦中,若转移9 mol电子,生成的L g。
26.(13分)A、B、C、D、E是元素周期表中前20号元素,已知:B元素原子K和L层电子数与其它电子层电子数之和相等;A是形成化合物种类最多的元素;c、D、E同周期,它们最高价氧化物对应水化物两两混合均能反应生成盐和水;E的正负化合价代数和为最大。
(1)B原子结构示意图: ;E离子的电子式 ;
(2)B与E的离子半径:rB rE(填“>”,“<”,“=”);
(3)写出D单质与c的最高价氧化物对应水化物溶液反应的离子方程式:
(4)C与D最高价氧化物的熔沸点 高于 (填“C”或“D”)
(5)B能与A形成B2A3离子化合物,它遇水能发生强烈反应,写出B2A3与水反应的化学方程式: 。
12.下列各组溶液中离子浓度大小关系正确的是 ( )
A.5mL.0.2 mol·L-1的HNO3溶液与10mL,0.1 mol·L-1的氨水混合
C(NH4+)>C(NO3-)>C(OH-)>C(H+)
B.10mL 0.2 mo1·L-1的盐酸与0.1 mol·L-1的醋酸钠10mL溶液混合
C(Cl一)>C(H+)>C(Na+)>C(CH3COO-)>C(OH一)
C.10mL 0.1 mol·L-1 NH4Br和10mL 0.1 mol·L-1NaOH混合
C(Na+)=C(Br-)>C(H+)>C(OH-)
D.Cl mol·L-1CH3COOH与C2mol·L一1的NaOH等体积混合,溶液pH=7
C(Na+)>C(CH3COO-)>C(H+)=C(OH一)
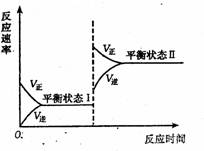 13.如图是某化学反应的反应速率随反应时
13.如图是某化学反应的反应速率随反应时
间变化的示意图。下列叙述与示意图相
符合的是 ( )
A.平衡状态I后,增加反应物浓度,达到平衡状态Ⅱ
B.平衡状态I后,升高温度,达到平衡状态Ⅱ,由此
推知该反应正反应为放热反应
C.平衡状态I后,增大压强,达到平衡状态Ⅱ,由此
推知该反应正反应为气体体积缩小的反应
D.平衡状态I后,使用适宜催化剂,达到平衡状态Ⅱ
11.下列肯定能达到目的的是 ( )
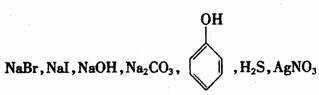 ①用一种试剂就能鉴别下列七瓶无色溶液:
①用一种试剂就能鉴别下列七瓶无色溶液:
②不用任何其他试剂可以鉴别下列四瓶无色溶液:
|
A.只有①能达到目的 B.只有②能达到目的
C.①②都达不到目的 D.①②都能达到目的
9.下列有关反应的离子方程式正确的是 ( )
A.向Ca(C1O)2溶液中通人二氧化硫:Ca2++2C1O-+SO2+H2O=CaSO3++2HCIO
B.Mg(HCO3)2溶液中滴加过量Ba(OH)2溶液:
2Ba2++Mg2++2HCO3-+4OH- Mg(OH)2↓+2BaCO3↓+2H2O
D.Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
 10.右图是某空间站能量转化系统局部示意图,其中燃料电池采用KOH溶液作电解质。下列有关说法正确的是 ( )
10.右图是某空间站能量转化系统局部示意图,其中燃料电池采用KOH溶液作电解质。下列有关说法正确的是 ( )
A.系统持续运行中不断消耗水
B.燃料电池的能量实际上是来自于水
C.水电解系统的阳极反应为:4OH- 一4e-
2H2O+O2↑
D.燃料电池放电时,负极反应为:2H++2e- H2↑
8.以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1mol金属铁与足量硫粉反应,转移2NA个电子
B.18g D2O中含有的质子数目为10 NA
C.1L lmol/L的FeC13溶液中含有铁离子的数目为NA
D.标准状况下,22.4L C14中含有氯原子数目为4NA
7.下列说法正确的是 ( )
A.在Na2O2晶体中阳离子与阴离子的物质的量之比为l:1
B.离子晶体中一定含有金属阳离子
C.水加热到很高的温度都难以分解是因为水分子问存在氢键
D.用鸡蛋壳内膜和蒸馏水除去淀粉胶体中的食盐
6. 2008年9月10日,欧洲核子研究中心的世界最大型电子对撞机正式启动。该对撞机有世 界上最大的冷却系统,一共加注了1万吨液态氮和130吨液态氦,其中液态氦用量约为世界年产量的1%,下列说法正确的是 ( )
A.3He与4He中子数相同,属于同位素
B.3He与4He物理性质、化学性质均相似
C.由3He、4He分别形成的分子都是单原子分子,分子内均无共价键
D.3He、4He质子数相同,属于同索异形体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com