
题目列表(包括答案和解析)
20.解:设O2的物质的量变化为x .
2SO2(g)+ O2
(g) 2SO3(g)
2SO3(g)
n(起始)mol 2 1 0
△n(变化)mol 2x x 2x
n(平衡)mol 2-2x 1-x 2x
则: 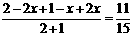 (1分) 解得:x=0.8mol
(1分) 解得:x=0.8mol
SO2的转化率为: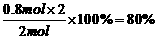
该反应2SO2(g)+ O2
(g) 2SO3(g)
平衡时的各物质的浓度为:
2SO3(g)
平衡时的各物质的浓度为:
c(SO2)= (2mol-2×0.8mol)÷20L=0.02mol/L c(SO3)= 2×0.8mol÷20L=0.08mol/L
c(O2)=(1mol-0.8mol) ÷20L=0.01mol/L
则平衡常数为:
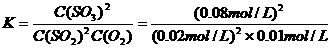 =1600L/mol
=1600L/mol
故SO3(g)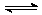 SO2(g)+1/2O2
(g)的平衡常数为:
SO2(g)+1/2O2
(g)的平衡常数为:
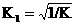 =
=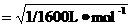 =
=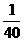 mol1/2L1/2
mol1/2L1/2
4、

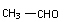
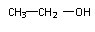
 CH2=CH2
CH2=CH2
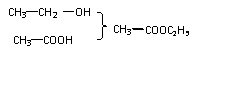
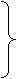
 3-甲基-3-戊醇
3-甲基-3-戊醇


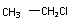
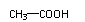 CH2=CH2
CH2=CH2
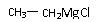 2分
2分
3、3 1分
2、 加成反应 3分
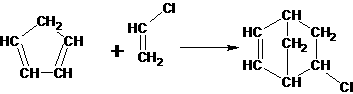
19.1、A:HCHO 2分
B: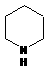 2分
2分
E:
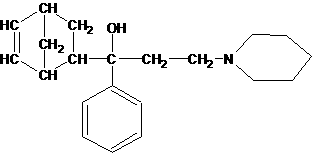 2分
2分
18. (1)Fe3++H2O=Fe(OH)3(胶体)+3H+
(1分)
(1)Fe3++H2O=Fe(OH)3(胶体)+3H+
(1分)
 (2)未见沉淀生成 反应后的镁条发现可被磁铁吸引
(各1分)
(2)未见沉淀生成 反应后的镁条发现可被磁铁吸引
(各1分)
 对反应后的溶液用激光束照射,看是否有明亮的光路即是否能产生丁达尔效应(2分)
对反应后的溶液用激光束照射,看是否有明亮的光路即是否能产生丁达尔效应(2分)
 根据反应生成大量气泡,则说明镁与H+存在镁拉动氯化铁水解平衡移动的反应,又根据反应后的镁条可被磁铁吸引,说明镁与氯化铁发生氧化还原反应,且最终将Fe3+还原为Fe单质。因此水解和氧化还原反应在镁与饱和氯化铁是竞争反应,同时存在。 (2分)
根据反应生成大量气泡,则说明镁与H+存在镁拉动氯化铁水解平衡移动的反应,又根据反应后的镁条可被磁铁吸引,说明镁与氯化铁发生氧化还原反应,且最终将Fe3+还原为Fe单质。因此水解和氧化还原反应在镁与饱和氯化铁是竞争反应,同时存在。 (2分)
(3)镁与氯化铁稀溶液只发生了拉动水解平衡的反应,且此条件下生成了Fe(OH)3沉淀。(1分)
(4)镁与浓、稀氯化铁溶液反应的现象机理均有所不同,说明条件对化学反应的重要性,化学研究中必须以实验事实为依据,结合理论分析,创造性的求的新知。 (2分)
17. (10分)(1)至(3)问每空1分,第(4)问各2分
(10分)(1)至(3)问每空1分,第(4)问各2分
 (1)防止催化剂中毒 (1分) (2)①Fe2+ (1分) ②4FeCO3+O2
(1)防止催化剂中毒 (1分) (2)①Fe2+ (1分) ②4FeCO3+O2 2Fe2O3+4CO2 ( 2分)
2Fe2O3+4CO2 ( 2分)
 ③K2SO4
(1分) ④ 滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(1分)
③K2SO4
(1分) ④ 滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(1分)
 (3)① 酸性高锰酸钾溶液(或碘水和淀粉的混合液)( 2分)
(3)① 酸性高锰酸钾溶液(或碘水和淀粉的混合液)( 2分)
 ② 实验时间和BaSO4的质量( 2分)
② 实验时间和BaSO4的质量( 2分)
16. ⑴四(1分)
Ⅷ ( 1分)
⑴四(1分)
Ⅷ ( 1分)
 ⑵2:1 (2分)
⑵2:1 (2分)
 ⑶②⑧(缺少1个给1分,添错得2分,2分)
⑶②⑧(缺少1个给1分,添错得2分,2分)
 ⑷3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑+ 2H2O
⑷3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑+ 2H2O
 (2分,未配平给1分,反应物或生成物写错1个或以上给0分)
(2分,未配平给1分,反应物或生成物写错1个或以上给0分)
 ⑸Fe2O3
+ 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 +
2H2O
⑸Fe2O3
+ 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 +
2H2O
 (2分,未配平给1分,反应物或生成物写错1个或以上给0分)
(2分,未配平给1分,反应物或生成物写错1个或以上给0分)
15.(1)KSP=c(Ag+)c(Cl-])(1分) ; 10-12 (1分)
 (2)Cl-抑制了AgCl的溶解,但Cl-浓度的增大使AgCl形成络合物:
(2)Cl-抑制了AgCl的溶解,但Cl-浓度的增大使AgCl形成络合物:
 AgCl + Cl- ==[AgCl2]- (2分)
AgCl + Cl- ==[AgCl2]- (2分)
 (3)AgI的溶解度小于AgCl的溶解度(2分)
(3)AgI的溶解度小于AgCl的溶解度(2分)
 (4)白色沉淀溶解,形成无色溶液(2分);Ag Cl-+2NH3=Ag(NH3)2++ Cl-(2分)
(4)白色沉淀溶解,形成无色溶液(2分);Ag Cl-+2NH3=Ag(NH3)2++ Cl-(2分)
21.
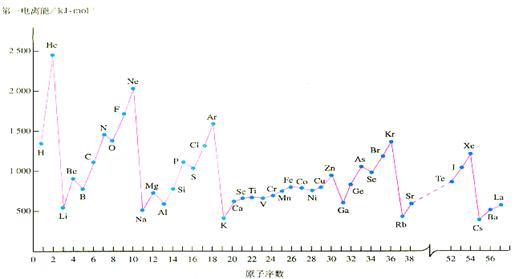 (12分)教材中给出的各物质的第一电离能的数据如下
(12分)教材中给出的各物质的第一电离能的数据如下
 请回答下列问题:
请回答下列问题:
 (1)Al的第一电离能比Mg的低,理由是:__________________________。
(1)Al的第一电离能比Mg的低,理由是:__________________________。
 (2)稀有气体的第一电离能都处在峰顶,碱金属的第一电离能都处在谷底,原因是:______________________________________________________________。
(2)稀有气体的第一电离能都处在峰顶,碱金属的第一电离能都处在谷底,原因是:______________________________________________________________。
 稀有气体中的Xe能形成氧化物XeO3,已知该氙原子上有1对孤对电子,则XeO3分子构型为_____型结构;Xe的杂化类型为__________________。碱金属的晶胞类型为钾型,其晶胞名称叫:__________________,它的空间利用率比铜型的___________(填:高、低)。
稀有气体中的Xe能形成氧化物XeO3,已知该氙原子上有1对孤对电子,则XeO3分子构型为_____型结构;Xe的杂化类型为__________________。碱金属的晶胞类型为钾型,其晶胞名称叫:__________________,它的空间利用率比铜型的___________(填:高、低)。
 (3)上图中也给出了过渡元素的第一电离能数据,他们都与核外电子的排布有关,则Cr的外围电子排布式为:____________________________________。
(3)上图中也给出了过渡元素的第一电离能数据,他们都与核外电子的排布有关,则Cr的外围电子排布式为:____________________________________。
 (4)Mn 元素的外围电子排布式为3d54s2 ,Fe元素的外围电子排布式为3d64s2 ,请解释Mn的第三电离能比Fe的第三电离能大的原因是:____________________________。
(4)Mn 元素的外围电子排布式为3d54s2 ,Fe元素的外围电子排布式为3d64s2 ,请解释Mn的第三电离能比Fe的第三电离能大的原因是:____________________________。
 (5)从上图中可以看出N原子的第一电离能与O第一电离能出现了反常现象,这与N原子的核外电子排布的特殊性有关,这样就使氮的单质及化合物具有一些特殊的性质,请回答下列问题:①写出一种与N2互为等电子体的阴离子的路易斯结构式_________________________.②氨分子极易溶于水,原因是:______________________。
(5)从上图中可以看出N原子的第一电离能与O第一电离能出现了反常现象,这与N原子的核外电子排布的特殊性有关,这样就使氮的单质及化合物具有一些特殊的性质,请回答下列问题:①写出一种与N2互为等电子体的阴离子的路易斯结构式_________________________.②氨分子极易溶于水,原因是:______________________。
 ③向硫酸铜的溶液中加入少量氨水,产生_____色的沉淀,继续加氨水则形成________色的透明溶液,其阳离子的结构为________________________(要表示出配位键),若加入极性较小的溶剂乙醇,将析出__________色的晶体,该物质的化学式为:_________________。
③向硫酸铜的溶液中加入少量氨水,产生_____色的沉淀,继续加氨水则形成________色的透明溶液,其阳离子的结构为________________________(要表示出配位键),若加入极性较小的溶剂乙醇,将析出__________色的晶体,该物质的化学式为:_________________。




















 参考答案和评分标准
参考答案和评分标准
 选择题(1-8题,每小题3分,错得0分。9-14题,每小题4分,共若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。)
选择题(1-8题,每小题3分,错得0分。9-14题,每小题4分,共若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com