
题目列表(包括答案和解析)
1.C 2.C 3.BD
讲析:1.分子的电子式的书写,主要是注意共用电子对的数目,同时不要忘记未参与成键的电子。 2.金属晶体的熔沸点有的很高如W,有的很低如碱金属。 3.组成分子的元素化合价是形成8电子结构的价态时符合题意。
16.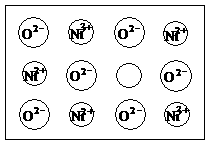 ⑴中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
⑴中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
⑵天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如右图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电
中性,但化合物中Ni和O的个数比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
第10课时 (A卷)
典型题点击
15. 已知某元素A能与ⅦA族某一元素B生成A的最高价化合物X,在化合物X中B的含量为92.2%,而在与此相应的A的氧化物Y中,氧的含量为72.7%。A与B生成的化合物X为一无色透明液体,沸点77℃,对氢气的相对密度为77。
已知某元素A能与ⅦA族某一元素B生成A的最高价化合物X,在化合物X中B的含量为92.2%,而在与此相应的A的氧化物Y中,氧的含量为72.7%。A与B生成的化合物X为一无色透明液体,沸点77℃,对氢气的相对密度为77。
回答下列问题(不必给出计算过程):
(1)A元素名称 ,并指出属于第 周期第 族;
(2)X的分子式 ,分子空间构型 ,键角 ;
(3)Y的分子式 ,分子空间构型 ,键角 ;
(4)列举化合物X的两种用途 、 。
14.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A ,B ,C ,D 。
(2)在由A、B、C、D四种元素两两组成的二元化合物中,
非极性分子有 ;其结构中存在非极性键的分子晶体有 ;其结构中存在非极性键的离子晶体有__________;(各填一种物质的化学式)
(3)写出两种均含有A、B、C、D四种元素的化合物两种: 、 。
13. a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数( 单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示) (3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属 (5)c微粒是 ,f微粒是
(用化学式表示)
12. 许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为 ( )
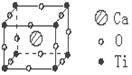 A.Ca4TiO3
A.Ca4TiO3
B.Ca4TiO6
C.CaTiO3
D.Ca8TiO12
11.关于氢键,下列说法正确的是 ( )
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
 C.DNA中的碱基互补配对是通过氢键来实现的
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
10. 已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可知ABn型分子是非极性分子的经验规律是 ( )
A.分子中所有原子在同一平面内
B.分子中不含氢原子
C.在ABn型分子中,A元素为最高正价
D.在ABn型分子中,A原子最外层电子都已成键
9. 若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为 ( )
A.CH4·14H2O B.CH4·8H2O
C. CH4·(23/3)H2O D.CH4·6H2O
8.下列关于天然气水合物中两种分子极性的描述正确的是 ( )
A 两种都是极性分子
B 两种都是非极性分子
C CH4是极性分子,H2O是非极性分子
D H2O是极性分子,CH4是非极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com