
题目列表(包括答案和解析)
9.将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g)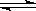 2H2+O2
2H2+O2
2CO+ O2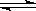 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为 n(O2)平=a mol, n(CO2)平=b mol。试求n(H2O)平= 。(用含a、b的代数式表示)
8.在一恒定的容器中充入2 mol A和1
mol B发生反应:2A(g)+B(g)  x
C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6
mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为
x
C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6
mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
7.可逆反应3A(g) 3B(?)+C(?);ΔH>0。随着温度升高,气体平均相对分子质量有变小趋势,则下列判断中正确的是( )
3B(?)+C(?);ΔH>0。随着温度升高,气体平均相对分子质量有变小趋势,则下列判断中正确的是( )
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体
6.在密闭容器中,对于反应:2SO2(g)+O2(g)  2SO3(g),SO2和O2起始时分别为20 mol和10
mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
2SO3(g),SO2和O2起始时分别为20 mol和10
mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
A.10 mol和10% B.20 mol和20%
C.20 mol和40% D.20 mol和80%
5.一定温度下,将amolPCl5通入一个容积不变的密闭容器中,发生反应:PCl5(g)
 PCl3(g)+Cl2(g)反应达平衡时,测得混合气体的压强为P1,此时再向容器中通入amolPCl5,同样温度下再度达到平衡时,测得压强为P2。下列判断正确的是( )
PCl3(g)+Cl2(g)反应达平衡时,测得混合气体的压强为P1,此时再向容器中通入amolPCl5,同样温度下再度达到平衡时,测得压强为P2。下列判断正确的是( )
A.2P1>P2 B.PCl5的分解率增大
C.2P1<P2 D.Cl2的体积分数增大
4.放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A.K2 和K1的单位均为mol/L B.K2 <K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
3.某温度下,反应H2(g)+I2(g)  2HI(g);ΔH<0。在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
2HI(g);ΔH<0。在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,压缩体积,平衡不移动,混合气体颜色加深
B.恒压,充入HI(g),开始时正反应速率减小
C.恒容,升高温度,正反应速率减小
D.恒容,充入H2, I2(g)的体积分数降低
2.在固定容积的密闭容器中,A和B发生下列反应,A(s)+2B(g)  2C(g);ΔH>0。在一定条件下达到平衡,若升高温度则达平衡后混合气体的( )
2C(g);ΔH>0。在一定条件下达到平衡,若升高温度则达平衡后混合气体的( )
A.平均相对分子质量增大
B.平均相对分子质量减小
C.密度增大 D.密度减小
1.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)
5.有体积相同的两个密闭容器,分别都充有1mol N2气体和3molH2气体,在相同温度下发生如下反应:N2(g)+3H2(g)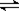 2NH3(g);△H<0,并达到平衡。在这过程中,一容器保持体积不变(定容容器),另一容器保持压强不变(定压容器),则:
2NH3(g);△H<0,并达到平衡。在这过程中,一容器保持体积不变(定容容器),另一容器保持压强不变(定压容器),则:
(1)哪个容器中的反应先达到平衡?答:
哪个容器中的N2的转化率高?答:
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在定容容器中,上述反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为A、B、C摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),应满足的条件是:
①若x=0,y=0,则z= ,
②若x=0.75,则y应为 mol、z应为 mol。
③x、y、z应满足的一般条件是 。
检测提高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com