
题目列表(包括答案和解析)
4.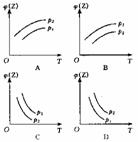 反应:X(g)+3Y(g)
反应:X(g)+3Y(g)  2Z(g) ;△H<0在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的体积分数φ随温度变化的曲线应为(
)
2Z(g) ;△H<0在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的体积分数φ随温度变化的曲线应为(
)
3.已知723K时反应:2SO2(g)+O2(g)  2SO3(g);ΔH=-Q。在相同温度下,向一密闭容器中通入2molSO2和1molO2达到平衡时放出热量Q1,向另一容积相同的密闭容器中通入1molSO2和0.5molO2达到平衡时,放出的热量为Q2,则Q1、Q2满足的关系是 ( )
2SO3(g);ΔH=-Q。在相同温度下,向一密闭容器中通入2molSO2和1molO2达到平衡时放出热量Q1,向另一容积相同的密闭容器中通入1molSO2和0.5molO2达到平衡时,放出的热量为Q2,则Q1、Q2满足的关系是 ( )
A.Q2=Q1/2 B.Q2<Q1/2
C.Q2<Q1<Q D.Q1=Q2<Q
2.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的体积分数一定增加;②生成物的产量一定增加;③反应物的转化率一定增大;④反应物浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥使用了合适的催化剂。
A.①② B.②⑤ C.③⑤ D.④⑥
1.对于一可逆反应,改变条件,达到平衡后,生成物浓度增加,平衡移动方向应是( )
A.向左移动 B.向右移动
C.不移动 D.不确定
6.因不注意题给物质的状态,造成了浓度、压强对化学平衡移动影响的误判。
纠错训练
5.改变压强要看有没有改变参加反应的气体浓度,若气体浓度不变,则不能对平衡产生影响。
4.不要把平衡向正反应方向移动与原料转化率提高等同起来。反应物转化率、生成物的含量也可能提高,但也可能降低。
3.不要把v正增大与平衡向正反应方向移动等同起来,只有v正>v逆,才能使平衡向正反应方向移动。
2.对于未达到平衡状态的可逆反应误用勒夏特列原理来分析,没有注意使用勒夏特列原理的前提条件。
1.化学平衡研究的对象是可逆反应,可逆反应不能进行到底,即使条件改变,化学平衡产生移动,移动的结果都不可能使可逆反应体系中任何一种组成成分的浓度变为0。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com