
题目列表(包括答案和解析)
2.金属钛对人体无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关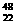 Ti和
Ti和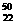 Ti的说法中正确的是
Ti的说法中正确的是
A.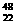 Ti和
Ti和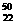 Ti 原子中均含有22个中子
Ti 原子中均含有22个中子
B.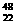 Ti和
Ti和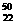 Ti在周期表中位置相同,都在第4纵行
Ti在周期表中位置相同,都在第4纵行
C.分别由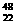 Ti和
Ti和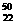 Ti组成的金属钛单质物理性质相同
Ti组成的金属钛单质物理性质相同
D.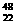 Ti16O2和
Ti16O2和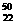 Ti18O2互为同位素
Ti18O2互为同位素
1.自2009年1月1日开始,我国起征燃油税。减少汽油等成品油的使用是这次税费改革的目的之一。下列说法中不正确的是
A.汽车尾气中的“黑烟”会增加空气中固体颗粒的含量
B.汽车尾气中的碳氢化合物会加剧温室效应
C.汽车尾气的大量排放是形成光化学烟雾的重要原因
D.工业上将石油蒸馏得到汽油,发生了化学变化
27.(10分)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业。回答下列问题:
(1)元素电负性:D____E (填>、<或=)
(2)A、C单质熔点A_____C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F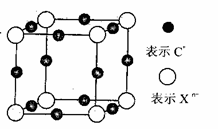 与NH3之间的化学键为_______
与NH3之间的化学键为_______
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。
该晶体中阳离子和阴离子个数比为_______,晶体中每个Xn-被_____个等距离的C+离子包围。


26.解热镇痛药阿司匹林缓释片具有药效长的特点。合成路线如下:
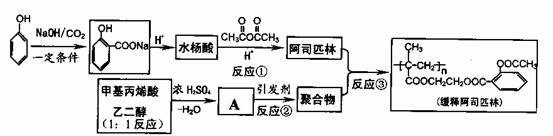 请回答:
请回答:
(1)写出反应类型:反应②_______;反应③_______________
(2)写出A的结构简式:___________
(3)写出反应①的反应方程式:_____________________________
(4)除水杨酸外,该物质的芳香族同分异构体还有_____种(要求苯环上连有两个有机基团,其中一个是羟基)。1mol阿司匹林最多消耗_______NaOH。
25.(10分)食品安全关系到国计民生,备受关注。
Ⅰ、山梨酸(CH3CH=CHCH=CHCOOH)是高效安全的食品防腐剂。
(1)下列关于山梨酸性质叙述不正确的是__________
A.能与溴水发生加成反应 B.能使酸性高锰酸钾褪色
C.碱性条件系能水解 D.能发生加聚反应
(2)山梨酸还可以合成类似于天然橡胶的高分子材料,合成路线如下:
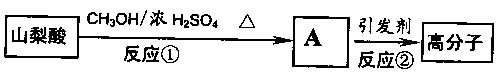
写出①的反应方程式:________________________;②的反应类型:_________
Ⅱ三鹿奶粉添加三聚氰胺致死婴儿重大事故令人震惊。请回答下列问题:
(1)奶粉中蛋白质平均含氮量为16%,三聚氰胺中氮的质量分数为______
(2)三聚氰胺在人体内发生取代反应(水解),生成三聚氰酸(下图),
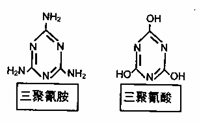
写出三聚氰胺水解方程式______________________
(3)不法企业在原奶中添加尿素CO(NH2)2,高温下可以生成三聚氰胺和NH3、CO2,奶粉中不含尿素了,但是含氮量仍然较高。写出尿素高温产生三聚氰胺的化学方程式________
24.(12)甲醇合成反应为:CO(g)+2H2(g) D CH3OH(g)工业上用天然气为原料,分为两阶段:
 Ⅰ、制备合成气:CH4+H2O(g)
DCO+3H2O。为解决合成气中H2过量CO不足问题,原料气中添加CO2:CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________
Ⅰ、制备合成气:CH4+H2O(g)
DCO+3H2O。为解决合成气中H2过量CO不足问题,原料气中添加CO2:CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________
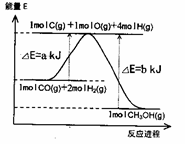
Ⅱ、合成甲醇:(1)反应过程中物质能量变化如右图所示。
写出合成甲醇的热化学方程式_________________。
实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
|
|
10min |
20min |
30min |
40min |
50min |
60min |
|
3000C |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
|
5000C |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在3000C反应开始10分钟内,H2的平均反应速率_____________
(3)5000C平衡常数K=___________
(4)在另一体积不变的容器中,充入1.2molCO2和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率。(写出计算过程)
23.(12分)氯碱厂废渣(盐泥)中含有镁钙铁铝的硅酸盐和碳酸盐,其中含镁(以MgO计)约10%,钙(以CaO计)约15%,铁(Ⅱ、Ⅲ)和铝等的含量低于1%。氯碱厂从盐泥中提取MgSO4.7H2O的流程如下:
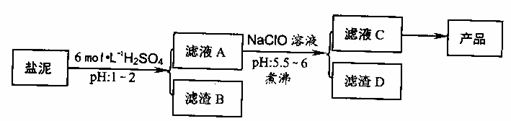
部分阳离子以氢氧化物沉淀时溶液pH
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
11.2 |
溶解度表
|
温度0C |
10 |
30 |
40 |
|
CaSO4 |
0.19 |
0.21 |
0.21 |
回答下列问题:
(1) 滤渣B的主要成分是:__________________
(2)  从滤渣A得到滤液C,能否用安睡代替NaClO?_________,说么理由________,其中加热煮沸的目的是_________________
从滤渣A得到滤液C,能否用安睡代替NaClO?_________,说么理由________,其中加热煮沸的目的是_________________
(3) 从滤液C中获得产品经过3个操作步骤,分别是________,________,_______
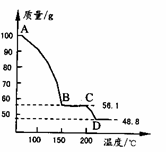
(4) 将一定质量的MgSO4.7H2O放在坩埚中加热测得不同温度阶段剩余固体质量如右图所示。
(5) 据图写出CD段反应的化学方程式__________________。
22.(12分)
对钢铁零件进行表面发蓝处理可大大增强抗蚀能力。其主要工艺如下:
(1)预处理:把钢铁零件分别浸入105℃的1.0mol/L Na2CO3溶液→20℃水→20℃30%盐酸→20℃水。其中酸浸的目的是 。
(2)氧化发蓝处理:把预处理后钢铁零件浸入1400c 1L发蓝液中(15.6mol/LNaOH、3.26mol/LNaNO2),发生如下反应:
3Fe+NaNO2+5NaOH=3Na2FeO2+NH3+H2O;
3Na2FeO2+ NaNO2+5H2O =3Na2Fe2O4+NH3+7NaOH
Na2FeO2+ Na2Fe2O4+2H2O= Fe3O4+4NaOH
总反应可以表示为____________。测得发蓝处理残留液NaOH浓度为16.0mol.L-1,则反应中转移电子为________mol(假设体积不变)
(3)氧化膜致密性检查:①浓硝酸、硫酸、③氯水、④硫酸铜溶液、⑤KSCN溶液、⑥NaOH溶液。请选用上述合适试剂设计方案,检查发蓝零件的氧化膜致密性是否合格。填写下表:
|
实验步骤 |
现象 |
结论 |
|
|
|
产品不合格 |
(4)发蓝液废水中含有致癌物NaNO2,可以用氧化剂如漂白粉转变成硝酸钠,写出离子方程式:_________________
21.(9分)
化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度。请回答下列问题:
I、取20.00mL0.250mol/L H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定。滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
|
滴定次数 |
标准溶液体积/mL |
待测溶液体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
20.00 |
1.50 |
23.70 |
|
2 |
20.00 |
1.02 |
21.03 |
|
3 |
20.00 |
2.00 |
21.99 |
(1) 滴定时,KMnO4溶液应装在______滴定管中(选填:酸式、碱式)。
(2) 滴定终点的判断方法是: 。
(3) 根据上述数据计算,该KMnO4溶液的浓度为 mol/L
(4) 下列操作中使得KMnO4溶液浓度偏低的是 。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定前盛放标准H2C2O4溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定管内在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
II、滴定中发现,KMnO4紫红色褪去的速度开始时很慢、后来变快、最后又变慢。为研究由慢到快的原因,甲同学继续进行了下列实验,实验数据如下表:
|
编号 |
温度/℃ |
酸化的H2C2O4溶液/mL |
KMnO4溶液/mL |
溶液褪色时间/s |
|
1 |
25 |
5.0 |
2.0 |
40 |
|
2 |
25 |
5.0(另外加少量MnSO4粉末) |
2.0 |
4 |
|
3 |
60 |
5.0 |
2.0 |
25 |
(5)分析上述数据,对确定过程中反应速率由快到慢的合理解释是 。
20.(8分)
已知某白色混合物粉末中含有 Al2 (SO4)3、Na2SO4、NH4HCO3、NH4Cl、KCl五种物质中的两种。请完成下述探究混合物组成的实验
限选仪器、用品与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、酒精灯、火柴、试管夹;紫色石蕊试纸;1mol·L-1硝酸、1mol·L-1盐酸、1mol·L-1NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
I、初步探究
取适量混合物于烧杯中,用蒸馏水完全溶解,得到无色透明溶液A;取少量A于试管众,滴加稀硝酸,有无色气泡产生,继续滴加稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)上述实验证明:该混合物中肯定含有 (名称),肯定不含有
(化学式)
II、进一步探究
(2)为了进一步确定该混合固体的组成,需要进行实验1或实验1、2,完成下表:
|
实验操作 |
预期现象和结论 |
|
实验1:取少量溶液B于试管中,加入少量
Ba(NO3)2溶液,振荡,静置观察。 |
|
|
实验2: |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com