
题目列表(包括答案和解析)
9.以下实验或操作能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.用托盘天平准确称取0.400g的NaOH固体配成1000mL浓度为0.0100 mol·L-1的溶液
C.把纯净的铁和锌用导线连接一起插入到经过酸化的3%的NaCl溶液中,往铁电极区
滴入2滴KSCN,有红色出现
D.含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2,充分反应后过滤可除去Ca(OH)2
8.在下述条件下,一定能大量共存的离子组是
A.无色透明的水溶液中:K+、Mg2+、I-、MnO4-
B.pH=1的NaNO3水溶液中:NH4+、Fe2+、SO42-、Cl-
C.c(HCO3-)=0.1mol/L的溶液中:Na+、K+、Ba2+ 、Br-
D.由水电离产生的c(OH-)=1×10-14mol/L的溶液中:H+、Al3+、Cl-、NO3-
7.短周期主族元素A、B、C、D原子序数依次增大。已知:A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A< D < B < C
B.D的氢化物稳定性大于C的氢化物稳定性
C.B在自然界中以游离态和化合态两种形态存在
D.B的氧化物属于酸性氧化物,可溶于氢氧化钠溶液
6.下列能达到实验目的的是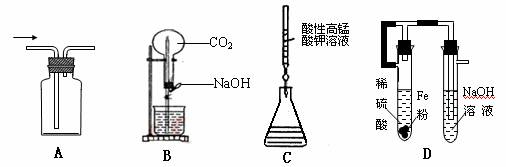
A.防倒吸的安全瓶 B.喷泉实验 C.滴定分析 D.制取氢氧化铁沉淀
5.Na2 FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2 FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
4.类推是化学学习和研究中常用的思维方法。下列类推正确的是
A.由2CO2+2Na2O2====2Na2CO3+O2推出SO2与Na2O2反应也一定生成Na2SO3和O2
B.金属Na着火不能用干冰灭火,金属K着火也不能用干冰灭火
C.由硫酸铜能使蛋白质变性推出硫酸铵也能使蛋白质变性
D.F2、Cl2、Br2、I2的熔点依次升高,N2、P4、As、Sb、Bi的熔点也依次升高
3.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定错误的是
A.14g分子式为CnH2n的(n≥2)烃中含有的C=C的数目一定为NA/n
B.含有2NA个阴离子的CaC2,在标准状况下,能产生约44.8L的乙炔气体
C.非标准状况下1.7gNH3体积为2.24 L
D.16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数约为0.2×6.02×1023
2.下列有关工业生产的叙述正确的是
A.工业上可以用铝热反应来冶炼大量铁: Fe2O3 +2Al 高温==== Al2O3 +2Fe
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.CaCO3可用于炼铁、制水泥、制玻璃
1.2008 年北京奥运会主体育场的外形好似“鸟巢” ( The Bird Nest )。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除 B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是
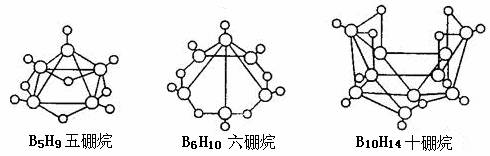
A.硼烷与水反应是非氧化还原反应
B.8个硼原子的巢式棚烷化学式应为 B8H10
C.2B5H9 + 12O2点燃====5B2O3 十9H2O ,l molB5H9完全燃烧转移25mol电子
D.这类巢式硼烷的通式是 BnH n + 4
21.(1)镁失去的电子是相对稳定的已充满的3S电子,需要提供额外的能量;铝失去的的是3P电子,3P电子的轨道能比3S电子轨道能高。
(2)稀有气体都达到满电子层结构,失去电子需要提供额外的能量,而碱金属最外层只有一个电子,容易失去。
三角锥形,SP3 杂化。体心立方晶胞,低。
(3)3d54s1
(4)Fe2+转化为Fe3+时,3d能级有不稳定的3d6状态转变为3d5半满状态,所需的能量较小。
(5)①CN- ②氨分子和水分子之间能形成氢键③蓝色,深蓝色,选修3第42页,深蓝色,选修3第42页

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com