
题目列表(包括答案和解析)
11.某原电池反应总的离子方程式为:Zn+2H+ =Zn2++H2↑,则下列说法正确的是
A.硝酸可作电解质溶液
B.在电解质溶液中电子从正极流向负极
C.锌极质量不变
D.石墨可作原电池的正极
10.阿斯巴甜(Aapartame),具有清爽的甜味,甜度约为蔗糖200倍,其结构如图,有关阿斯巴甜的说法不正确的是
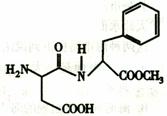
A.阿斯巴甜分子式为:C14H17N2O5
B.分子结构中含有一个羧基
C.水解产物中含有2种氨基酸
D.阿斯巴甜在一定条件下既能与酸反应,又能与碱反应
9.某金属单质的晶体在不同温度下其粒子有两种不同的空间排列方式,分别如图所示。则A、B中实际含有的粒子个数之比为
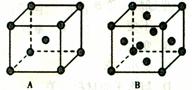
A.2︰1 B.1︰2 C.9︰14 D.2︰7
8.在某澄清、透明的浅黄色溶液中,可能含有:H+、NH4+、Fe3+、Ba2+、Al3+、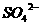 、
、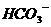 、
、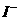 八种离子中的几种,在检验方案设计时初步分析其溶液中最多可含的离子(不包括
八种离子中的几种,在检验方案设计时初步分析其溶液中最多可含的离子(不包括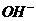 )有
)有
A.5种 B.6种 C.7种 D.8种
7.20℃~C时,NaCl的溶解度是36g,此时NaCl饱和溶液的密度为1.12 g/cm3,在此温度下NaCl饱和溶液中NaCl的物质的量浓度为
A.0.15 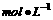 B.1.36
B.1.36 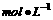 C.5.07
C.5.07 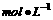 D.6.15
D.6.15 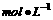
6.下列反应所对应的离子方程式正确的是
A.醋酸钠的水解反应: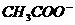 +H3O+ = CH3COOH+H2O
+H3O+ = CH3COOH+H2O
B.碳酸氢钙溶液与过量的NaOH溶液反应:
Ca2++2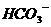 +2
+2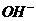 =CaCO3↓+2H2O+
=CaCO3↓+2H2O+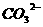
C.苯酚钠溶液与二氧化碳反应:2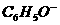 +CO2+H2O
+CO2+H2O  2C6H5OH +
2C6H5OH +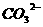
D.稀硝酸与过量的铁屑反应:3Fe+8H++2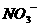 =3Fe3++2NO↑+4H2O
=3Fe3++2NO↑+4H2O
29.(16分)近年来,从中药当归中提取了一种化学物质叫阿魏酸,它是一种抗氧化剂,可作食品防腐剂,其结构为:
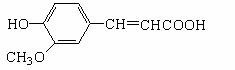
工业上也可以通过合成制取阿魏酸。
|
|
 RCHO+CH2(COOH)2
RCH=C(COOH)2+H2O
RCHO+CH2(COOH)2
RCH=C(COOH)2+H2O
 RCH=C(COOH) 2
RCH=CHCOOH+CO2
RCH=C(COOH) 2
RCH=CHCOOH+CO2
下面是工业上以丙二酸(CH2(COOH)2)和另一种芳香族化合物A合成阿魏酸的一种路径:
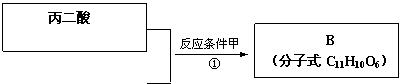

|
回答下列问题:
(1)下列关于阿魏酸的说法中正确的是
①与FeCl3溶液作用,溶液显紫色,②遇溴水只发生加成反应,③能发生酯化反应,④可以发生聚合反应,⑤能发生水解反应,⑥能发生消去反应
(2)已知A含有多种官能团,除甲氧基(-OCH3)外,还含有的官能团名称是: ,
(3)B的结构简式为: 。
(4)写出反应①的化学方程式
(5)A有多种同分异构体,写出其中满足下列条件的所有可能的结构简式:
①在苯环上只有两个取代基;②在苯环上的一氯取代物有2种;
③分子中不含碳碳双键; ④等物质的量的A分别与足量的Na、NaOH反应时消耗Na、NaOH的物质的量之比是2:1
。
28.(15分)法国化学家亨利·莫瓦桑一生在化学元素发现史上做出了重大贡献。莫瓦桑最初的无机化学研究课题是自燃铁(发火金属;打火石)。莫瓦桑将氧化亚铁放在氢气流下加热还原,制得了自燃铁(颗粒很细的金属铁,在空气中撞击或受热会燃烧)。
某研究性学习小组拟模仿莫瓦桑开展在实验室制备自燃铁研究。由于没有现存的氧化亚铁,查资料得知可以通过在隔绝氧气条件下加热草酸亚铁(FeC2O4)制得氧化亚铁: FeC2O4 FeO+CO↑+CO2↑
FeO+CO↑+CO2↑
由此,小组设计了一套先制备氧化亚铁,继后制备自燃铁的装置(铁架台等固定仪器装置在图中略去未画出):
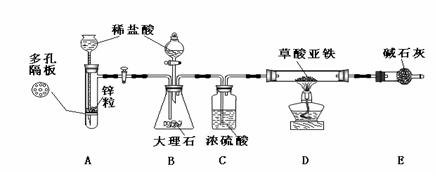
分析该套装置的原理回答下列问题:
(1)写出用氧化亚铁制备自燃铁的化学方程式:
(2)仪器组装好后,首先要做的是: ;
具体操作是:
。
(3)实验中B装置的意义是: 。
(4)进行第二阶段制备自燃铁实验步骤的正确顺序是:
①点燃D处酒精灯, ②关闭A、B之间的活塞开关,③熄灭酒精灯,④往D的玻管内通相对足够时间的气体排出原存留气体,⑤继续通气体至D的玻管内固体冷却,⑥撤下仪器,⑦打开A、B之间的活塞开关
(5)该套装置有没有明显的问题? ,如有,回答如何改进:
。
27.(16分)某强酸性溶液X,含有Ba2+、Al3+、 SiO32-、NH4+、Fe2+、Fe3+、CO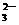 、SO
、SO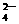 、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是: ,不能肯定的是: 。对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中根据现象就可判断,则该试剂最好是: ①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液
(2)气体F的化学式为: ,沉淀G的化学式为: ,沉淀K的化学式为: ,实验中,可以观察到反应②的现象是: 。
(3)写出步骤①所有发生反应的离子方程式
。
(4)要使步骤③中,D、H2O、O2三种物质恰好发生化合反应,则D、H2O、O2物质的量之比是: 。
26.(13分)短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物。
(1)写出E的单质与A、D两元素形成其常见化合物反应的离子方程式___________________________________________________。
(2)由A、C、D三元素所形成的常见盐溶液呈_________性(填“酸”、“中”、“碱”),其原因用离子方程式表示为:__________________________________________。
(3)B的相对分子质量最小的氢化物的燃烧热为890.3kJ·mol-1,写出其燃烧时的热方程式___________________________________________________________。
(4)X是含有A、C两元素的化合物,在工业上用X和空气(空气中氧气的体积分数为0.2)为原料生产盐Z的过程如下:
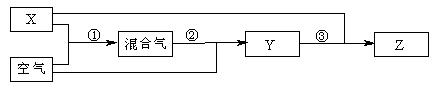
(a)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为__________________________________________________________________________。 (b)若不考虑副反应且各步反应均完全,为使生产盐Z的过程中不再补充空气,则原料气中X的体积分数最大值为多少?(要求写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com