
题目列表(包括答案和解析)
28.(15分)
(1)酚酞(1分) 锥形瓶中溶液由无色变为浅红色,且半分钟内不褪去。(2分)
(2)偏大 (2分)
(3)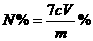 (2分)
(2分)
(4)不是 (2分)
(5)①(NH4)2SO4+2NaOH 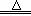 Na2SO4+2NH3↑ +2H2O (2分)
Na2SO4+2NH3↑ +2H2O (2分)
②b (2分)
③A、B装置间缺-个干燥装置、缺少赶尽反应装置中残留氨气的装置(2分) 其他合理答案也给分。
27. (15分)
(1)第三周期VA族,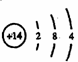 (4分)
(4分)
(2)2Al+6H+=2Al3++3H2 ↑ (2分)
(3)PH3,PCl3 (4分)
(4)CO2,C02属于分子晶体,Si02属于原子晶体 (3分)
冶炼硅或制玻璃、光导纤维的原料。 (2分)
26.(15分)
(1)b、d (3分) (2)①25% 23.1 (每空3分) ②> (2分)
(3)阴 N2 +
6H+ +6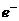 = 2NH3
(每空2分)
= 2NH3
(每空2分)
6.B 7.C 8.A 9.B 10.A 11.D 12.D 13.C
29.(15分)芳香酯类化合物A、B互为同分异构体,均只含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度都是97,分子中C、H原子个数相同,且C、H原子总数是氧原子数的5倍。
已知:各有机物之间存在如下转化关系
C和D是相对分子质量相同的不同类有机物;F经连续氧化可生成C。
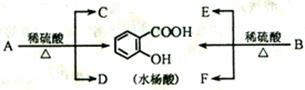
(1)求A的分子式,写出推导及运算过程。
(2)B的结构简式是 。
(3)完全燃烧时,1 mol D与1 mol下列 的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(4)水杨酸与小苏打反应的化学方程式是 。C与F反应的化学方程式是 。
(5)同时符合下列要求的同分异构体有 种。
①与A互为同分异构体;②可以水解;③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(6)1 mol上述(5)中的一种有机物X,能与含4 mol NaOH的溶液恰好完全反应,写出此反应的化学方程式 。
28.(15分)硫酸铵是一种常用的铵态氮肥,其优等品的含氮量≥21.0%。化工生产中常用酸碱滴定法间接测定氮肥中氮的含量,其原理是利用硫酸铵与甲醛作用,反应方程式如下:2(NH4)2SO4+6HCHO (CH2)6N4+2H2SO4+6H2O。反应中生成的酸可用NaOH标准溶液滴定,达到滴定终点时,溶液pH约为8.8。
(CH2)6N4+2H2SO4+6H2O。反应中生成的酸可用NaOH标准溶液滴定,达到滴定终点时,溶液pH约为8.8。
课外活动小组对某硫酸铵化肥的品质进行探究。实验步骤如下:
称取硫酸铵样品mg放入烧杯中,加适量蒸馏水溶解,转移至100mL容量瓶中并定容至刻度,摇匀。用移液管吸取20.00 mL该溶液于锥形瓶中,加入18%中性甲醛溶液5 mL(已足量),放置反应5 min后,加1-2滴某种指示剂,用c mol/L NaOH标准溶液滴定至终点,记下所耗NaOH标准溶液的体积Vm L。重复做2-3次,计算试样中的含氮量。回答下列问题:
(1)滴定时,应选用的指示剂是 ,终点时的现象为 。
(2)甲醛溶液中常有微量的甲酸,若使用前不处理至接近中性,对测定结果的影响是 (填“偏大”、“偏小”、“无影响”)。
(3)样品含氮量的计算式为 (可不化简)。
(4)该小组同学用电子天平准确称取5.300 g硫酸铵化肥样品,最后用去1.000 mol/L NaOH标准溶液15.00 mL刚好滴定至终点。则该化肥 (填“是”或“不是”)优等品。
(5)有一位同学甲用右图所示装置进行实验,根据装置B的增重也能测定样品的含氮量。
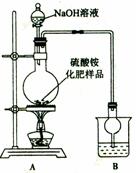
①烧瓶内发生反应的化学方程式为: 。
②烧杯中盛放的试剂最好是 (填字母)
a.浓硫酸 b.稀硫酸 c.水
③同学乙认为,该实验装置中存在两处明显的缺陷,会导致测定结果不准确。
这两处缺陷分别 、 。
27.(15分)五种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
E |
|
相 关 信 息 |
可形成多种单质,其中一种单质有剧毒,少量常保存在水中。 |
原子的K层电子数是L、M层电子数之差的2倍。 |
单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶于强酸和强碱溶液。 |
单质和氧化物均为与金刚石具有相似结构的空间网状晶体,有很高的熔、沸点。 |
所处周期数、族序数都与其原子序数相等。 |
(1)A在周期表中的位置是 ,D的原子结构示意图 。
(2)写出C单质溶于B、E形成的化合物的溶液时反应离子方程式 。
(3)A、D两元素的氢化物分子,较稳定的是 (填分子式)。A与B形成的一种化合物X的各原子最外层均达到8个电子的稳定结构,X的化学式为 。
(4)F是与D同主族的短周期元素,D、F的最高价氧化物中熔点较低的是 (填化学式),原因是 ,写出D的最高价氧化物的一种用途 。
26.(15分)合成氨对工农业生产和国防都有重要意义。
已知:N2(g)+3H2(g)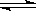 2NH3(g);△H= 一92.4
2NH3(g);△H= 一92.4 。请回答:
。请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是 (填字母)。
a.用铁触媒加快化学反应速率
b.采用较高压强(20MPa-50MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1mol N2和3 mol H2并发生反应。
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N2的转化率α1= ,此时,反应放热 kJ;
②若容器压强恒定,则达到平衡时,容器中N2的转化率α2 α1(填“>”、“<”或“=”)。
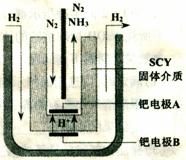
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是
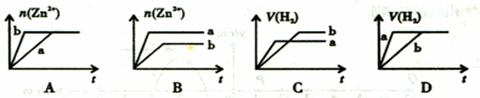
13.将等质量的两份锌粉分别加入盛有等体积等浓度的稀硫酸的a、b两个烧杯中,并向a烧杯中再加入少量CuO粉末。则下列关系图中正确的是(不考虑水解)
12.下列说法中,不正确的是
A.除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液,振荡后分液
B.用渗析(透析)的方法可除去肾病患者血液中的毒素物质
C.用重结晶法可分离NaCl和KNO3的混合物
D.除去FeCl3溶液中少量的CuCl2,可加入足量的铁粉充分反应后过滤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com