
题目列表(包括答案和解析)
1.化学与能源、信息、材料密切相关。下列说法错误的是
A.石油的催化裂化是为了提高从石油得到的汽油等轻质油的产量和质量
B.开发太阳能、水能、风能等能源,可减少煤、石油等化石燃料的使用
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.氧化铝常用于制造耐火材料,氧化铁常用于制造红色油漆和涂料
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21.(12分)
A.在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇。
 (1)下列说法正确的是 ▲ (选填序号)。
(1)下列说法正确的是 ▲ (选填序号)。
A.第一电离能:碳原子大于氧原子
B.CO2分子中含有2个σ键和2个π键
C.CH4分子中碳原子采用sp3杂化
D.二甲醚的沸点比乙醇高
(2)镍原子基态时的核外电子排布式 ▲ 。
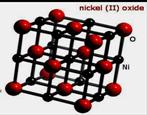
(3)NiO晶胞如右上图所示,每个晶胞中与每个Ni2+距离相等且最近的Ni2+有 ▲ 个,某种有缺陷的氧化镍晶体由Ni2+、Ni3+、O2-及空隙组成,可表示为Ni0.98O,则n(Ni2+)/n(Ni3+)=
▲ 。
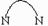
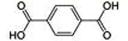
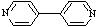 (4)对苯二甲酸( )、4,4’-联吡啶[ (可简化为 )]等与Ni2+能形成多核配合物。配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:
(4)对苯二甲酸( )、4,4’-联吡啶[ (可简化为 )]等与Ni2+能形成多核配合物。配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:
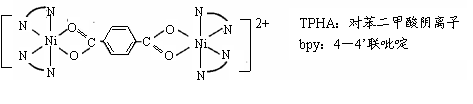
该络合物中配位原子是: ▲ ;依据价层互斥理论,ClO4-空间结构为 ▲ 型。
B.孔雀石的主要成分是Cu(OH)2·CuCO3 (其杂质主要为FeCO3等),它用于制于胆矾的实验步骤如下:
①在100 mL烧杯中加入3 mol·L-1稀硫酸12 mL,加热,少量多次加入5~10 g孔雀石粉,控制硫酸铜溶液的pH约为1.5-2.0,并加水稀释至35 mL左右。
②滴加约4 mL 3% H2O2,待滴加完后,用2 mol· L-1 NaOH溶液调节溶液的酸度,控制pH值为3.0-3.5,将溶液加热至沸数分钟,趁热过滤。
③水浴加热,蒸发结晶
④重结晶
试回答下列问题:
(1)步骤①中为什么要少量多次加入孔雀石粉? ▲ ;用硫酸浸取的化学方程式:
▲ 。
(2)pH值控制为3.0-3.5,其目的是: ▲ ;加过氧化氢发生反应的离子方程式为:
▲ 。
(3)为什么必须水浴加热及怎样判断蒸发浓缩已完成: ▲ 。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重计录如下表:

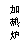
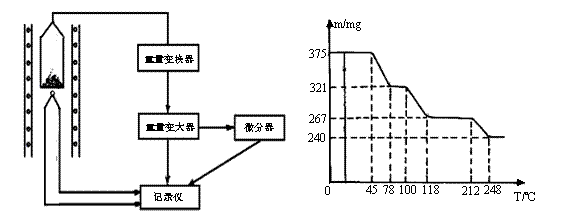 写出212-250℃温度范围内发生反应的化学方程式:
▲ 。
写出212-250℃温度范围内发生反应的化学方程式:
▲ 。
盐城市2008/2009学年度高三年级第三次调研考试
20.(10分)今有X、Y、Z三种有机物(其相对分子质量均小于100),它们含碳、氢、氧、氮4种元素中的三种或四种。有一合作学习小组的同学拟确定它们的组成或结构。
(1)测定有机物相对分子质量所用的方法通常是 ▲ (填序号,下同。①红外光谱,②质谱,③氢核磁共振谱,④元素分析);下列物质的氢核磁共振谱只有一个吸收峰的是 : ▲
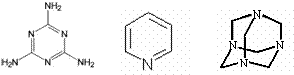
(① 新戊烷, ② , ③ , ④ )
(2)X由C、H、O、N四种元素组成,ω(N)=18.67%,且X既能与盐酸反应又能与氢氧化钠溶液反应,则X可能的结构简式为: ▲ 。
(3)Y和Z的相对分子质量相等,它们完全燃烧时,只能生成CO2、H2O、N2中的两种或三种。某同学取一定量的Y和Z的混合物,完全燃烧时在标准状况下的实验结果如下:
|
实验序号 |
混合物 质量 |
物质的量关系n(Y)/n(Z) |
产物的量 |
||
|
m(CO2)/g |
m(H2O)/g |
V(N2)/mL |
|||
|
① |
3g |
2∶3 |
3.08 |
1.8 |
672 |
|
② |
3g |
3:2 |
3.52 |
1.8 |
448 |
试根据实验结果,通过计算确定Y和Z的分子式。
19.(12分)氟苯水杨酸(diflunisal)是一种新型的水杨酸类消炎解热镇痛良药,具有强效、长效
低毒等特点。一种可行的合成路线如下(催化剂及溶剂等已省去):
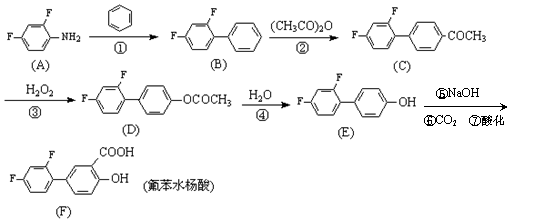
试回答下列问题:
(1)有关氟苯水杨酸的下列说法正确的是 ▲ (选填序号)。
A.分子中只含两种官能团
B.分子中所有原子可以处于同一平面
C.1mol氟苯水杨酸与足量的碳酸氢钠溶液反应,可生成2molCO2
D.在一定pH条件下,氟苯水杨酸遇FeCl3溶液能发生显色反应
(2)图中有机物(A)为2,4-二氟苯胺,它有多种同分异构体,其中含有苯环结构的异构体(不含本身)有 ▲ 种。
 (3)上述反应中属于取代反应的有: ▲ (选填序号:①②③④)。
(3)上述反应中属于取代反应的有: ▲ (选填序号:①②③④)。
(4)反应②的方程式为: ▲ 。
(5)参照上述合成氟苯水杨酸的原理,试以苯酚为原料逐步合成乙酰水杨酸( )
(用反应流程图表示)。 ▲ 。
18.(10分)一些较活泼的金属在某些特定的介质环
境中,会变为惰性状态,这是由于金属表面上
覆盖了一层氧化膜。铁在不同浓度的硝酸中溶
解与钝化情况如图如示。试探究下列问题:
(1)现有一枚光亮的铁钉,欲使其表面形成钝化
层,应将其放入浓度大于 ▲ 的硝酸
中一段时间;证明其表面已形成一层致密的
钝化层的简单实验是: ▲ 。
(2)下列有关说法不正确的是 ▲ (选填序号)。
A.铜难溶于冷的浓硫酸,是因为铜在浓硫酸中发生钝化
B.铜片和铝片用导线连接后插入冷的浓硝酸中,电流一定总是由铜电极沿导线流入铝极
C.铁在硝酸溶液中的腐蚀速率与硝酸浓度一定呈正比
D.可用冷的浓硝酸除去铝制容器内的水垢
(3)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:3Fe+NaNO2+5NaOH 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: ▲ 。
(4)为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应: ▲ 。
17.(10分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
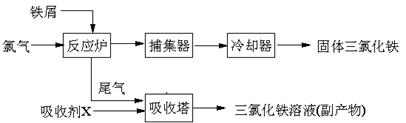 (1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为: ▲ 。
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为: ▲ 。
(2)已知六水合氯化铁在水中的溶解度如下:
|
温度/℃. |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是: ▲ 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为: ▲ 。
(4)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ▲ mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(5)吸收剂X是: ▲ ;吸收塔中吸收剂X的作用是: ▲ 。

 (6)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol/LNa2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: ▲ 。
(6)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol/LNa2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: ▲ 。
16.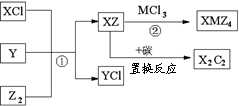 (8分)已知X、Y、Z、M均为短周期元素,且X、Y、Z位于同主族,Y、M同周期,原子半径:Y>X>Z。化合物XMZ4既是一种重要的还原剂又是一种高能燃料,其合成途径如下(部分产物未列出,答题时,X、Y、Z、M用所对应的元素符号表示)
(8分)已知X、Y、Z、M均为短周期元素,且X、Y、Z位于同主族,Y、M同周期,原子半径:Y>X>Z。化合物XMZ4既是一种重要的还原剂又是一种高能燃料,其合成途径如下(部分产物未列出,答题时,X、Y、Z、M用所对应的元素符号表示)
(1)实验室鉴别XCl与YCl的常用方法是: ▲ 。
(2)反应②的化学方程式为: ▲ 。
(3)上述反应应用于工业生产时,可以直接循环使用的物质是: ▲ 。
(4)X2C2与水反应可生成一种有机小分子,该有机小分子的结构式为: ▲ 。
15.(10分)CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室先用大理石(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙。实验流程如下(已知:Ca(OH)2+H2O2+6H2O→CaO2·8H2O △H<0):
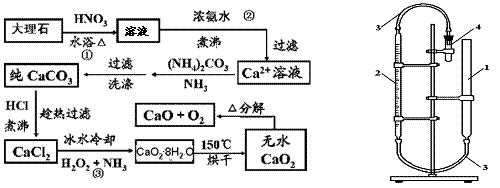
(1)写出CaO2的电子式: ▲ 。
(2)图示步骤②,加入浓氨水至弱碱性的目的是: ▲ 。
(3)步骤③发生反应的化学方程式为: ▲ 。
(4)步骤③用冰水冷却的可能原因是: ▲ 。
(5)用右上图的量气法可测定样品中CaO2的质量分数:先检查装置的气密性,然后在量气管中注入一定量的水,在仪器4的试管中注入9.0g样品,连接好装置;充分加仪器4所示的小试管。若在标准状况下收集到840mL气体,则CaO2纯度为: ▲ 。
14.氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②
4NH3(g) +5O2 4NO(g)+6H2O(g);△H=-905kJ/mol………………①
4NO(g)+6H2O(g);△H=-905kJ/mol………………①
4NH3(g) + 3O2(g)  2N2(g) + 6H2O(g);△H=-1268kJ/mol………②;
2N2(g) + 6H2O(g);△H=-1268kJ/mol………②;
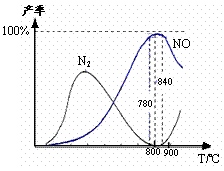 下列说法正确的是
下列说法正确的是
A.工业上进行氨催化氧化生成 NO时,温度应控制在780-840℃之间
B.工业上采用物料比n(O2)/n(NH3)在1.7-2.0,主要是为了提高反应速率
C.在加压条件下生产能力可提高5-6倍,是因为加压可提高转化率
D.氮气氧化为NO的热化学方程式为:N2(g)+ O2(g)  2NO(g);△H=+181.5
kJ/mol
2NO(g);△H=+181.5
kJ/mol
第Ⅱ卷(非选择题 共72分)
13.已知苯酚钠能与卤代烃(RX)发生取代反应生成酚醚(C6H5OR)。ATBS是一种阻燃剂,可由双酚A(BPA)经三步合成。下列说法正确的是
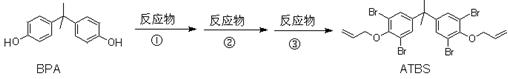
A.BPA分子中所有碳原子可以处于同一平面
B.ATBS的分子式为:C21H19Br4O2
C.反应①、②、③的反应物分别为NaOH、 ClCH2CH=CH2、Br2
D.由苯酚和丙酮(CH3COCH3)合成BPA可能生成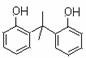 和
和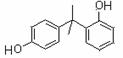 副产物
副产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com