
题目列表(包括答案和解析)
21.选做题,共计12分。本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,将按A题评分。
A.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E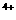 离子和氩原子的核外电子排布相同。
离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
 (2)下列叙述正确的是
。(填字母)
(2)下列叙述正确的是
。(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个 键和1个
键和1个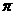 键
键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧的配位数为 。
(4)电镀厂排放的废水中常含有剧毒的BC 离子,可在Q的催化下,先用NaClO将 BC
离子,可在Q的催化下,先用NaClO将 BC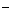 氧化成BCD
氧化成BCD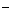 ,再在酸性条件下BCD
,再在酸性条件下BCD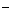 继续被NaClO氧化成C2和BD2。
继续被NaClO氧化成C2和BD2。
① A、B、C、D四种元素的电负性由小到大的顺序为 。
② 与BCD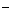 互为等电子体的分子、离子的化学式依次为
(各写1种)。
互为等电子体的分子、离子的化学式依次为
(各写1种)。
③ 上述反应中后一步反应的离子方程式是 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3·6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为 。
B.硝酸钾既是一种重要的工业原料又是一种优质的无氯钾氮复合肥,实验室可通过下列 所示的流程制备之。
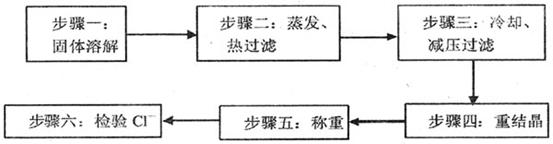
硝酸钾等四种盐在不同温度下的溶解度(单位:g)见下表。
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
60℃ |
80℃ |
100℃ |
|
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
110.0 |
169 |
246 |
|
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
45.5 |
51.1 |
56.7 |
|
NaNO3 |
73 |
80 |
88 |
96 |
104 |
124 |
148 |
180 |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.3 |
38.4 |
39.8 |
请回答下列问题:
(1)该制备流程实际是工业制取硝酸钾过程的实验室再现,则步骤一所溶解的固体 是 (答物质的名称)。
(2)在步骤二中,先蒸发(通过加热、搅拌进行)使溶液浓缩,这时会有 (答 物质的名称)晶体逐渐析出;当溶液体积减少到约原来的一半时,迅速趁热过滤,但承接滤液的烧杯应预先加适量的蒸馏水,则此蒸馏水的作用是 。
(3)为便于吸滤,在安装减压过滤装置时,应使吸滤瓶的支管口与 相 对。吸滤完成后,吸滤瓶中的溶液应从 倒出。
(4)从溶液中析出的晶体颗粒的大小与结晶的条件有关。下列叙述正确的是 。(填字母)
a.在一定条件下,溶质的溶解度越小或溶液的浓度越低,析出的品粒就越细小
b.在一定条件下,溶剂的蒸发速度越慢或溶液冷却得越慢,析出的晶粒就较大
c.在一定条件下,溶质的溶解度越大或溶液冷却得越快,析出的品粒就就较大
d.当溶液过饱和时,振荡容器或向溶液中投入几粒晶体,都能促使晶体析出
(5)在步骤六对产品进行CI 检验的目的是
。
检验的目的是
。
(6)该制备硝酸钾的化学原理之一是利用不同物质的溶解度随温度的变化而发生不 同的变化,具体的说就是 。又某化工厂用KCI、HNO3溶液和O2为原料反应制备硝酸钾,同时副产C12等,则该反应的化学方程式为 。
徐州市2008-2009学年度高三第三次调研考试
20.(10分)乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,由乙醇制取氢气 具有良好的应用前景。已知由乙醇制取氢气可有如下两条路线:
① 水蒸气催化重整:
CH3CH2OH(g)+H2O(g)====4H2(g)+2CO(g) 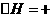 255.58 kJ·mol
255.58 kJ·mol
② 部分催化氧化:
CH3CH2OH(g)+1/2 O2(g)====3H2(g)+2CO(g)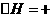 13.76 kJ·mol
13.76 kJ·mol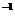
请回答下列问题:
(1)下列说法正确的是 。(填字母)
A.从原料消耗的角度来看,路线①制氢更有价值
B.从能量消耗的角度来看,路线①制氢更加有利
C.由于路线②制氢要消耗很多能量,故在实际生产中意义不大
D.路线①和路线②均使用催化剂,是为了降低反应所需的能量
(2)在体积为l L的密闭容器中充入2 mol CO和4 mol H2,一定条件下发生反应: 4H2(g)+2CO(g) CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g) 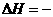 255.58kJ·mol
255.58kJ·mol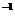 欲使
欲使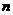 (CH3CH2OH)/
(CH3CH2OH)/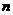 (CO)增大,应采取措施是
。(答两项即可)
(CO)增大,应采取措施是
。(答两项即可)
(3)若用0.8lt淀粉为原料,理论上可制得质量分数为92%的乙醇溶液 t。
(4)若用乙醇得到的合成气(CO、H2的混合气)来合成一种生物汽油。乙醇按路线① 和路线 ②
的反应各占50%,合成气合成生物汽油的反应为: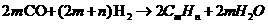
假定这种生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物,Y是烷烃。1 t质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),最终可得到X的质量为多少吨?
19.(12分)
已知:RCN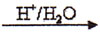 RCOOH。光学活性毗氟氯禾灵是选择性强、药效稳定、对人畜安全的多禾本科杂草除草剂,它的合成路线如下:
RCOOH。光学活性毗氟氯禾灵是选择性强、药效稳定、对人畜安全的多禾本科杂草除草剂,它的合成路线如下:
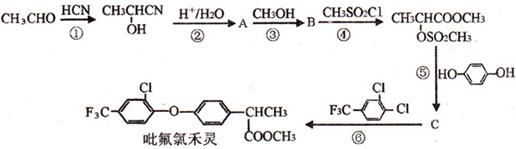
试回答下列问题:
(1)在吡氟氯禾灵的合成所涉及的反应中,属于加成反应的有 (填序号)。 在吡氟氯禾灵分子中含有 个手性碳原子。
(2)B的结构简式为 。
(3)CH3CH(OH)CN、物质C长期暴露在空气中均会变质,其原因分别是 。1 mol C分子最多可与 mol NaOH 完全反应。
(4)写出下列反应的化学方程式:反应⑥有 ;A发生缩聚反应 。
(5)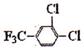 的含有三氟甲基(F3C一)和苯环的同分异构体共有
种。
的含有三氟甲基(F3C一)和苯环的同分异构体共有
种。
18.(10分)控制、治理氮氧化物对大气的污染是改善大气质量的重要方面。
(1)光化学烟雾白天生成,傍晚消失,其主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),某地早上至中午这些物质的相对浓度变化如右图所示,则下列叙述合
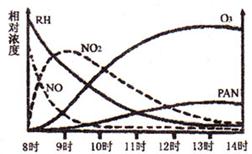 理的是
。(填字母)
理的是
。(填字母)
a.早上8时交通繁忙期,光化学烟雾的主要成分为RH、NO
b.14时,光化学烟雾的主要成分为O3、PAN
c.PAN、O3由RH和NO直接反应生成
d.PAN直接由O3转化生成
 (2)火力发电厂的燃煤排烟中含大麓的氮氧化物(NO
(2)火力发电厂的燃煤排烟中含大麓的氮氧化物(NO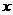 ),可利用甲烷和NO
),可利用甲烷和NO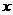 在一定 条件下反应消除其污染,则CH4与NO2反应的化学方程式为
。
在一定 条件下反应消除其污染,则CH4与NO2反应的化学方程式为
。
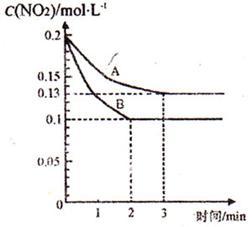
(3)在一密闭容器中发生反应2NO2 2NO+O2,反应过程中NO2的浓度随时间变化的情况如右下图所示。请回答:
2NO+O2,反应过程中NO2的浓度随时间变化的情况如右下图所示。请回答:
① 依曲线A,反应在前3 min内氧气的平均反应速率为 。
② 若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件是
(填“浓度”、“压强”、“温度”或“催化剂”)。
③ 曲线A、B分剐对应的反应平衡常数的大小关系是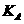
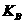 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
(4)一定温度下,在匦容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) I
4NO2(g)+O2(g) I
2NO2(g) 2NO(g)+O2(g) II
2NO(g)+O2(g) II
则反应I的平衡常数表达式为
。若达平衡时,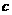 (NO2)=0.4 mol·L
(NO2)=0.4 mol·L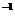 ,
,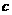 (O2)=1.3 mol·L
(O2)=1.3 mol·L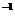 ,则反应II中NO2的转化率为
,N2O5(g)的起始浓度应不低于
mo1·L
,则反应II中NO2的转化率为
,N2O5(g)的起始浓度应不低于
mo1·L 。
。
17.(10分)
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
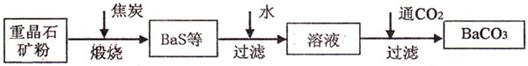
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)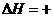 571.2 kJ·mol
571.2 kJ·mol
Ba(s)+S(s)+2O2(g):BaSO4(s)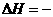 1473.2 kJ·mol
1473.2 kJ·mol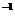
Ba(s)+S(s)=BaS(g)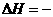 460 kJ·mol
460 kJ·mol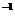
请回答:
(1)C(s)和O2(g)反应生成CO(g)的热化学方程式为 。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温, 应采取的措施是 。
(3)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:BaSO4(s)+CO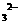 (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO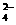 (aq)
(aq)
则:① 在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为 。
② 与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有 。
③ 已知: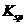 (BaCO3)=2.8×10
(BaCO3)=2.8×10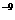 ,
,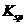 (BaSO4)=1.07×10
(BaSO4)=1.07×10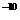 。现欲用沉淀转化法将0.39 mol BaSO4全部转化为BaCO3,如每次用1.00 L
2.0 mol·L
。现欲用沉淀转化法将0.39 mol BaSO4全部转化为BaCO3,如每次用1.00 L
2.0 mol·L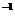 Na2CO3溶液处理,至少需要处理
次才能达到目的。
Na2CO3溶液处理,至少需要处理
次才能达到目的。
16、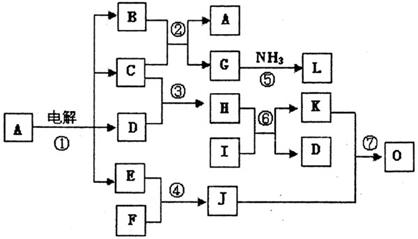 (8分)下列框图表示电解A的稀溶液以及一些常见物质间的转化关系,图中所有反应物、生成物及溶液中的水均未标出,C、D、E、F、I均为单质,其中C、D、E为气体,J为淡黄色固体,O为红褐色固体,L分子式为N2H4。
(8分)下列框图表示电解A的稀溶液以及一些常见物质间的转化关系,图中所有反应物、生成物及溶液中的水均未标出,C、D、E、F、I均为单质,其中C、D、E为气体,J为淡黄色固体,O为红褐色固体,L分子式为N2H4。
请回答下列问题:
(1)写出下列反应的化学方程式:反应⑤ 。反应⑦ 。
(2)N2H4是强还原剂,与氧化剂反应时放出大量的热,如N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)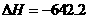 kJ/mol
kJ/mol
因此,N2H4可以作为火箭的推进剂。据此,你认为在常温下,氮气和水蒸气
(填“能”或“不能”)自发反应生成N2H4(1)和H2O2(1),原因是 。
(3)电解A溶液的过程中,如在阳极产生C、E气体的体积均为2.24 L(标准状况), 则在阴极产生气体的体积(标准状况)为 。
15、(10分)S2C12是一种金黄色易挥发的液体,具有强烈的窒息性,在工业生产上可用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组进行了以下探究。
[查阅资料]① 干燥的氯气在110℃-140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为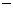 76℃、沸点为138℃。③ S2C12+C12
76℃、沸点为138℃。③ S2C12+C12 2SCl2。④ S2C12易和水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等。
2SCl2。④ S2C12易和水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等。
[实验装置设计]
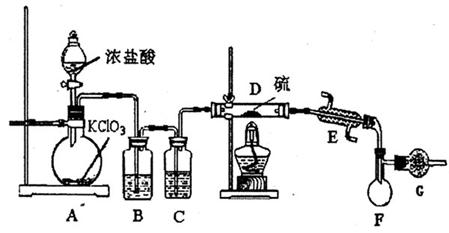
请回答下列问题:
(1)A中反应的离子方程式为 。
(2)B中所放试剂为 ;C中所放试剂为 。
(3)在加热D时温度不宜过高,其原因是 ;为了提高S2C12的纯度, 关键的操作是控制好温度和 。
 (4)G装置的作用是
。
(4)G装置的作用是
。
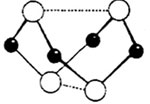
(5)又知6S2C12+16NH3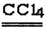 S4N4+8S+12NH4C1,且S4N4的结构如右图所示。若非金属性:S<N,试计算由C12制取S4N4的过程中,每消耗3 mol C12转移电子的物质的量为
。
S4N4+8S+12NH4C1,且S4N4的结构如右图所示。若非金属性:S<N,试计算由C12制取S4N4的过程中,每消耗3 mol C12转移电子的物质的量为
。
14.取某白色固体少量于试管中加热,固体逐渐消失,生成水蒸气和其它两种气体,试管 内除管口有少量水珠外,无任何残留物。另取该固体1.40g与过量烧碱液混合加热,生成一种使湿润红色石蕊试纸变蓝的气体,这些气体正好和120.0 mL,0.100 mol/L,H2SO4完全反应;再取该固体1.40 g跟足量盐酸反应,放出一种无色无臭的气体,这些气体通入过量的澄清石灰水中,得到1.60 g白色沉淀。下列说法正确的是
A.原白色固体一定是(NH4)2CO3
B.无法确定原白色固体的成份
C.原白色固体中不含任何金属离子
D.原白色固体一定是(NH4)2CO3和NH4HCO3的混合物
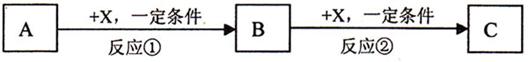
13.A、B、C、X均为中学常见的物质,它们之间有如下转化关系(其它产物已略去):
下列说法错误的是
A.若A是NH3,则C可能是氧化物
B.若A是非金属,则C可能是氧化物
C.若X是还原剂,则A可能是氧化物或金属
D.若X是强碱,则A可能是酸或盐
12.下列溶液中有关物质的量浓度关系一定正确的是
A.0.1 mol·L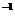 NaHA溶液的pH=9:
NaHA溶液的pH=9: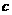 (Na
(Na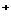 )>
)>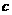 (HA
(HA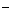 )>
)>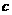 (OH
(OH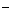 )>
)>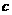 (H2A)>
(H2A)>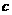 (A
(A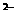 )
)
B.在NH4HCO3溶液中: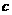 (H3O
(H3O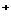 )+
)+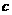 (H2CO3)=
(H2CO3)=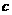 (OH
(OH )+
)+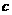 (CO
(CO )
)
C.稀盐酸中逐滴加入氨水至pH>7: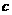 (NH
(NH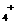 )>
)>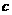 (Cl
(Cl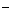 )>
)>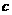 (OH
(OH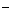 )>
)>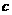 (H
(H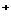 )
)
D.物质的量浓度相等的氨水和NH4Cl溶液等体积混合(设溶液中无氨分子存在): 2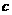 (H
(H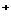 )+
)+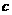 (NH
(NH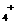 )=
)=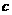 (NH3·H2O)+2
(NH3·H2O)+2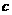 (OH
(OH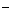 )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com