
题目列表(包括答案和解析)
4. 0.1mol/L的CH3COONa溶液和0.1mol/L的盐酸等体积混合后,溶液中离子浓度关系符合实际的是
A.c( )>c(CH3COOH)
)>c(CH3COOH)
B.c( )+c(
)+c( )=c(
)=c( )+c(
)+c( )
)
C.c( )+c(
)+c( )>c(
)>c( )
)
D.c( )+c(CH3COOH)=c(
)+c(CH3COOH)=c( )
)
3. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
A.加少量烧碱溶液 B.降低温度
C.加少量冰醋酸 D.加水
2. 将0.1mol/L醋酸溶液加水稀释,下列说法正确的是
A. 溶液中c(H+)和c(OH-)都减小
B. 溶液中c(H+)增大
C. 醋酸电离平衡向左移动
D. 溶液的PH增大
1. 一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成氢气的总量,可向盐酸中加入适量的
A. NaOH(固体) B. H2O C.HCl D.CH3COONa(固体)
6.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
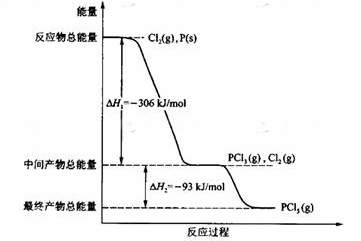
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率 1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为 2,
2, 2
2
 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3= ,P和Cl2一步反应生成1 mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
。
5.已知298K时, N2(g)+3H2(g)=2 NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是 ( )
A.Q1 = Q2 = 92.4kJ B.Q2 < Q1 = 92.4kJ
C.Q2< Q1< 92.4kJ D..Q2 = Q1 < 92.4kJ
4.化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是
 A.N2(g)+3H2(g)=2NH3(1);
△H=2(a-b-c)kJ·mol-1
A.N2(g)+3H2(g)=2NH3(1);
△H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+ H2(g)=NH3(1); △H=(h+c-a)kJ·mol-1
H2(g)=NH3(1); △H=(h+c-a)kJ·mol-1
D.  N2(g)+
N2(g)+ H2(g)=NH3(g); △H=(a+b)kJ·mol-1
H2(g)=NH3(g); △H=(a+b)kJ·mol-1
3.下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的
ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
2.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mlo-1、-1411.0kJ·mlo-1和-1366.8kJ,则由C2H4(g)和H2O(I)反应生成C2H5OH(I)的△H为
A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
C.-330kJ·mol-1 D.+330kJ·mlo-1
1.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。
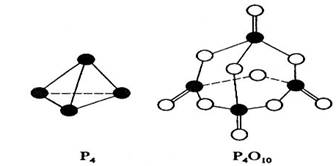
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com