
题目列表(包括答案和解析)
17.(14分)化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
[方案一]
称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为: ;
(2)实验中,需加热至恒重的目的是 。
[方案二]
称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-==BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是
。
[方案三]
按如下图所示装置进行实验:
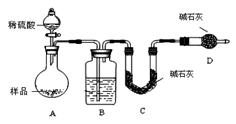
(1)D装置的作用是 。
分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重 8.80g,则样品中Na2CO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:
。
16.(6分)
(1)实验室中,欲配制一定物质的量浓度的稀硫酸,并用来测定未知浓度的烧碱溶液。
① 用24.5%硫酸(密度为1.20g·㎝-3)配制100mL0.200 mol·L-1硫酸,定容时,待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后的下一步操作是 。
② 用100mL0.200 mol·L-1硫酸测定未知浓度的烧碱溶液时,洗净的酸式滴定管应先 ,再盛装该稀硫酸标准液。
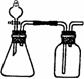 (2)利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中尾气处理装置略)的是
(填序号)。
(2)利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中尾气处理装置略)的是
(填序号)。
① 石灰石和稀盐酸 ② 二氧化锰和浓盐酸 ③ 铜和稀硝酸
④ 铜和浓硫酸 ⑤ 浓盐酸和浓硫酸 ⑥ 铝和烧碱溶液
15.单斜硫和正交硫是硫的两种同素异形体。
已知:①S(s,单斜) + O2(g)=== SO2 (g);△H1=-297.16kJ·mol-1
②S(s,正交) + O2(g) === SO2 (g);△H2=-296.83kJ·mol-1
下列说法正确的是 ( )
A.S(s,单斜)===S(s,正交) ;△H3 = +0.33kJ·mol-1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多297.16kJ
第Ⅱ卷 (非选择题 共55分)
14.将两个铂电极插人KOH溶液中,向两极分别通人CH4和O2,构成甲烷燃料电池。已知。通人CH4的一极,其电极反应式是:CH4 + 10OH――8e-===CO32-+7 H2O;通入O2的另一极,其电极反应式是:2O2 + 4H2O + 8e-=== 8OH-。下列叙述不正确的是 ( )
A.通人CH4的电极为负极 B.正极发生氧化反应
C.燃料电池工作时,溶液中的OH-向负极移动 D.该电池使用一段时间后应补充KOH
13.下列各组离子因发生氧化还原反成而不能大量共存的是 ( )
A.Ba2+、Cl-、CO32- B.NH4+、Mg2+、OH-
C.Na+、H+、SO32- D.Fe2+、H+、NO3-
12.下列化学方程式书写错误的是 ( )
A.乙醇催化氧化制取乙醛: 2CH3CH2OH+O2
 2CH3CHO+2H2O
2CH3CHO+2H2O
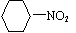
 B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯:
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯: 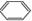 +HNO3
+ H2O
+HNO3
+ H2O
C.乙酸和乙醇发生反应生成乙酸乙酯:
CH3CH2OH + CH3COOH
 CH3COOC2H5
+ H2O
CH3COOC2H5
+ H2O
D.乙烯使溴的四氯化碳溶液褪色: CH2=CH2 + Br2 → CH2Br-CH2Br
11.短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是 ( )
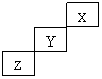 A.X、Y、Z三种元素中,X的非金属性最强
A.X、Y、Z三种元素中,X的非金属性最强
B.Y的氢化物的稳定性比Z的弱
C.Y的最高正化合价为+7
D.X的单质的熔点比Z的低
10.合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分 析下表中的数据,不能形成合金的是 ( )
|
|
Na |
Cu |
Al |
Fe |
|
熔点/℃ |
97.8 |
1083 |
660 |
1535 |
|
沸点/℃ |
883 |
2567 |
2467 |
2750 |
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
9.有关常温下pH均为3的醋酸和硫酸的说法正确的是 ( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol·L-1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
8.四氯化硅还原法是当前制备较高纯度硅的一种方法,有关反应的化学方程式为: SiCl4 + 2H2高温4HCl + Si
下列说法不合理的是 ( )
A.反应制得的硅可用于制造半导体材料
B.增大压强有利于加快上述反应的化学反应速率
C.四氯化硅可以由粗硅与氯气通过化合反应制得
D.混入少量空气对上述反应无影响
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com