
题目列表(包括答案和解析)
9.下列叙述正确的是 ( )
A.容量瓶、滴定管、烧杯、蒸馏烧瓶、量筒等仪器上都具体标明了使用温度
B.冷浓硫酸保存在敞口的铝制的容器中
C.为了使过滤速率加快,可用玻璃棒在过滤中轻轻搅拌,加速液体流动
D.KNO3晶体中含有少量NaCl,可利用重结晶的方法提纯
10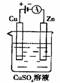 .肼(N2H4)又称联氨,可用作火箭燃料。肼一空气燃料电池中的电解质溶液是20%-30%的KOH溶液。该燃料电池可作为右上图装置中的电源。下列判断错误的是
.肼(N2H4)又称联氨,可用作火箭燃料。肼一空气燃料电池中的电解质溶液是20%-30%的KOH溶液。该燃料电池可作为右上图装置中的电源。下列判断错误的是
A.放电时:负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑
B.该燃料电池放电时KOH的浓度将保持不变
C.阴极质量增加128g时该电池消耗O21mol
D.电路中转移4 mol电子时该电池消耗的能量理论上与肼的燃烧热值相等
8. 下列化学用语或模型图正确的是
下列化学用语或模型图正确的是
A.1-丁醇的结构简式:C4H10 O B.四氯化碳的电子式 :
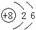

C.C2H4的比例模型: D.14C的原子结构示意图:
7.下列叙述错误的是 ( )
A.能发生酯化反应的酸不一定都是羧酸 B.淀粉、纤维素、油脂都属于高分子化合物
C.天然蛋白质水解的最终产物均为氨基酸 D.油脂水解得到的醇是丙三醇
27.(10分)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
⑴配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
⑵配合物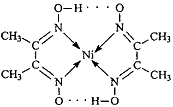 分子内的作用力有
(填编号)。
分子内的作用力有
(填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
 ⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③
⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为
形。
、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为
形。
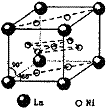
⑷氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点。该晶体的化学式 。
26. (10分)某有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为:
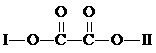
(其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如下转化
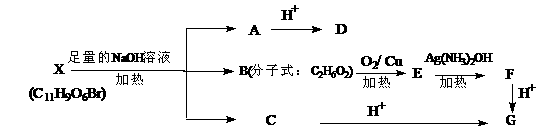
已知向D的水溶液中滴入FeCl3溶液发生显色反应,滴入NaHCO3溶液有无色无味
气体产生,且D苯环上的一氯代物有两种。
(1)D中的官能团名称: ;X的结构简式:
(2)写出E→F的化学方程式:
(3)D可能发生的反应有:
A.加成反应 B.消去反应 C.取代反应 D.氧化反应 E.加聚反应
(4)D有多种同分异构体,遇FeCl3溶液发生显色反应,又能发生银镜反应,其中能水解的同分异构体的结构简式为: ,不能水解的同分异构体的结构简式为: (各写出一种)
25.(9分)
咖啡酸苯乙酯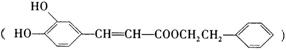 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:
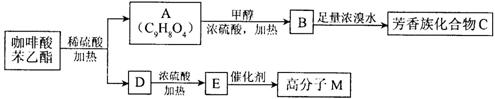
请填写下列空白。
⑴.D分子中的官能团是________。
⑵.高分子M的结构简式是______________。
⑶.写出A→B反应的化学方程式:___________________。
⑷.B→C发生的反应类型有______________。
⑸.A的同分异构体很多种,其中,同时符合下列条件的同分异构体有____种。
①苯环上只有两个取代基;
②能发生银镜反应;
③能与碳酸氢钠溶液反应;
④能与氯化铁溶液发生显色反应。
24.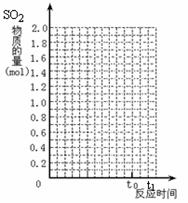 (12分)将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:
(12分)将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:
2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
 (1)该反应的平衡常数表达式为 。
(1)该反应的平衡常数表达式为 。
(2)反应进行到t0时SO2的体积分数为 。
(3)保持温度不变,若使用催化剂,在图中作出从
反应开始到t0点这段时间SO2物质的量变化曲线。
(4)当反应进行到t1时间时(t1>t0),给上述反应容
器加热到温度T2 (T2>T1),反应在t2 时间时(t2>t1)
重新达到平衡状 态,这时K值 (填“增大”
“减小”或“不变”),新平衡混合物中气体的总物质
的量 ______2.1 mol(填“<”、“>”或“=”)。
23.(12分)
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]为测定硫元素的含量
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
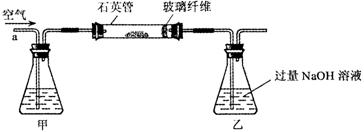
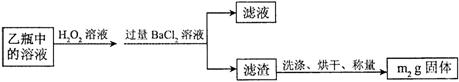
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
⑴.Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有_________________、_________________。
⑵.Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是_____________。
⑶.该黄铁矿中硫元素的质量分数为______________。
[实验二]设计以下实验方案测定铁元素的含量
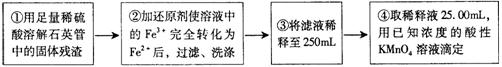
问题讨论:
⑷.③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有__________。
⑸.②中,若选用铁粉作还原剂,你认为合理吗?理由是:____________。
22.(10分)广东沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我省可持续发展的重要保证。
⑴海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
⑵某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
|
难溶电解质 |
Cu(OH)2 |
CuS |
Pb(OH)2 |
PbS |
|
Ksp |
4.8×10-20 |
6.3×10-36 |
1.2×10-15 |
1.0×10-28 |
⑶火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
 ①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
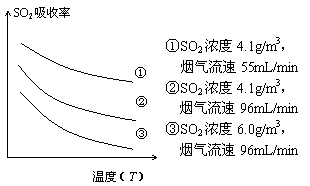
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:
。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是
21.(12分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
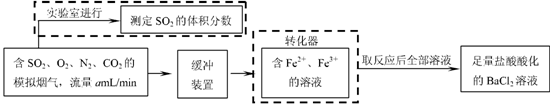

① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。
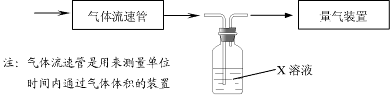
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
(3) 新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(4) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+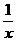 Sx 、
Sx 、
CO+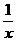 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+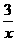 Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com